题目内容
11.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能( )| A. | x+2 | B. | x+4 | C. | x+18 | D. | x+34 |
分析 由元素周期表结构,对于处于ⅠA、ⅡA元素而言,同主族原子序数之差为上一周期元素的种类数;对于其他主族,同主族原子序数之差为下一周期元素的种类数,以此来解答.
解答 解:由元素周期表结构,对于处于ⅠA、ⅡA元素而言,同主族原子序数之差为上一周期元素的种类数;对于其他主族,同主族原子序数之差为下一周期元素的种类数,同一主族不同周期的元素,原子序数相差可能为2、8、18、32等或它们的组合,如10、26、34等,不可能相差4,即乙原子序数不可能为x+4,
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期中元素的种类数及同主族原子序数的关系为解答的关键,注意同主族元素不一定相邻,题目难度不大.

练习册系列答案
相关题目
10.下列物质中,不能通过单质间直接化合得到的是( )
| A. | FeCl3 | B. | CuS | C. | Na2O2 | D. | FeS |
2. 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
Ⅰ.实验前首先用浓度为0.1000mol/L酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)滴定过程中操作滴定管的图示正确的是A
(3)若配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”或“不变”)
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol/L.用该草酸按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
(4)写出表中a对应的实验目的探究温度不同对反应速率的影响;
(5)该小组同学对实验1和3分别进行的3次实验,测得以下实验数据(从混合振荡均匀开始计时)
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就缩短,即反应速率就越快”的结论.某同学认为该小组“探究反应物浓度对速率的影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案:其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示):2MnO4-+10Cl-+16H+=5Cl2↑+2Mn 2++8H2O.
 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.Ⅰ.实验前首先用浓度为0.1000mol/L酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)滴定过程中操作滴定管的图示正确的是A
(3)若配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”或“不变”)
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol/L.用该草酸按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性KMnO4溶液 | 实验目的 a.实验1和2探究___________ b.实验1和3探究反应物浓度对该反应速率的影响 c.实验1和4探究催化剂对该反应速率的影响 | |
| 体积 (mL) | 浓度 (mol/L) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(5)该小组同学对实验1和3分别进行的3次实验,测得以下实验数据(从混合振荡均匀开始计时)
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示):2MnO4-+10Cl-+16H+=5Cl2↑+2Mn 2++8H2O.
6.室温下,向a mol/L氨水中逐滴加入盐酸,下列描述不正确的是( )
| A. | pH减小 | B. | $\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$增大 | ||
| C. | 水的电离程度先减小后增大 | D. | Kb(NH3•H2O)不变 |
3.下列反应的离子方程式表示不正确的是( )
| A. | 漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AgNO3溶液中加入过量稀氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| D. | SO2使氯水褪色:SO2+Cl2+2H2O=SO42-+2Cl-+4H+ |
20.下列说法中正确的是( )
| A. | ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子 | |
| B. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| D. | 碱金属和卤素单质的熔沸点均随原子序数的增大而逐渐升高 |
1.下列化学用语正确的是( )
| A. | 聚乙烯的结构简式: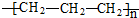 | B. | 丙烷分子的比例模型: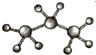 | ||
| C. | 四氯化碳分子的电子式: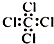 | D. | 2-乙基-1,3-丁二烯分子的键线式: |
