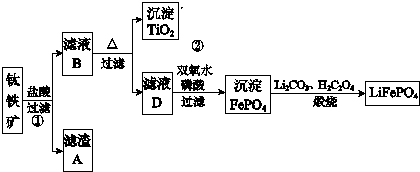
题目内容
2. 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.Ⅰ.实验前首先用浓度为0.1000mol/L酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)滴定过程中操作滴定管的图示正确的是A
(3)若配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”或“不变”)
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol/L.用该草酸按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性KMnO4溶液 | 实验目的 a.实验1和2探究___________ b.实验1和3探究反应物浓度对该反应速率的影响 c.实验1和4探究催化剂对该反应速率的影响 | |
| 体积 (mL) | 浓度 (mol/L) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(5)该小组同学对实验1和3分别进行的3次实验,测得以下实验数据(从混合振荡均匀开始计时)
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示):2MnO4-+10Cl-+16H+=5Cl2↑+2Mn 2++8H2O.
分析 Ⅰ(1)高锰酸钾具有强氧化性,能把草酸氧化成二氧化碳,自身被还原成二价锰离子;
(2)根据滴定管的使用规则判断;
(3)配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,溶液的体积偏小,配制的溶液的浓度偏大,滴定时消耗的高锰酸钾溶液的体积偏小;
Ⅱ(4)实验1、2只有温度不同,其他用量完全相同;
(5)高锰酸钾的物质的量相同,浓度不同的草酸溶液,可以探究反应物浓度对该反应速率的影响;
(6)酸性条件下,高锰酸根离子能将氯离子氧化成氯气.
解答 解:Ⅰ(1)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)根据滴定管的使用规则,滴定时,左手包住滴定管的活塞控制液滴的滴出,防止活塞被意外打开,即如图A所示操作;
故答案为:A;
(3)配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,溶液的体积偏小,配制的溶液的浓度偏大,滴定时消耗的高锰酸钾溶液的体积偏小,则消耗的高锰酸钾的物质的量偏小,由2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,测定的草酸的物质的量偏小,即测得的草酸溶液浓度偏低;
故答案为:偏低;
Ⅱ(4)实验1、2反应物用量完全相同,只有温度不同,目的就在于探究温度不同对反应速率的影响;
故答案为;探究温度不同对反应速率的影响;
(5)因根据表格中的褪色时间长短来判断浓度大小与反应速率的关系,需满足高锰酸钾的物质的量相同,浓度不同的草酸溶液,
故答案为:其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间;
(6)酸性条件下,高锰酸根离子能将氯离子氧化成氯气,自身被还原成二价锰离子,反应方程式为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O,
故答案为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
点评 本题考查了探究温度、浓度对反应速率的影响、浓度岁时间变化的曲线,题目难度中等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3.
| A. | 只有①或② | B. | 只有②或④ | C. | 只有①或②或③ | D. | ①②③④中任意一种 |
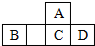 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )| A. | 简单氢化物的热稳定性:C>A | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 | |
| D. | 常温下它们的单质均为固态 |

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
 滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.(1)测定NaOH和Na2CO3的混合液中NaOH的含量.实验操作为:先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂).
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为溶液的颜色由红色变为浅红色,为何此种情况能测出NaOH的含量?能,酚酞的变色在碱性范围内,此时只有NaOH与HCl反应.
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?不能,滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量.准确称取5.0000g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI═3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250mL,然后用5.0×10-4mol•L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+
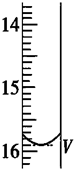
2S2O32-═2I-+S4O62-).取用Na2S2O3标准溶液应该用碱式式滴定管.有关实验数值如表(第一次滴定终点的数据如图所示,请将读得的数据填入表中).
| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | V=15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水.
| A. | x+2 | B. | x+4 | C. | x+18 | D. | x+34 |
| A. | 40K和40Ca原子中的质子数和中子数都相等 | |
| B. | 某元素原子最外层只有两个电子,它一定是金属元素 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |