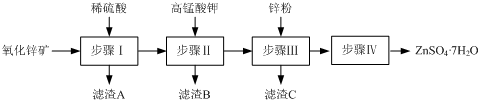
题目内容
10.下列物质中,不能通过单质间直接化合得到的是( )| A. | FeCl3 | B. | CuS | C. | Na2O2 | D. | FeS |
分析 A.Fe在氯气中燃烧生成FeCl3;
B.硫是弱氧化剂,所以Cu在S中加热生成硫化亚铜;
C.Na在空气中燃烧生成Na2O2;
D.硫是弱氧化剂,铁在硫蒸气中反应生成硫化亚铁.
解答 解:A、Fe在氯气中燃烧生成FeCl3而不是FeCl2,所以不能能由两种单质直接化合得到,故A不选;
B、铜在硫蒸气中燃烧直接生成硫化亚铜,故B选;
C、Na在空气中燃烧生成淡黄色固体Na2O2,所以能由两种单质直接化合得到,故C不选;
D、铁在硫蒸气中反应生成硫化亚铁,故D不选;
故选B.
点评 本题考查非金属单质的性质,明确硫具有弱氧化性,与变价金属反应生成较低价态金属硫化物,题目难度不大.

练习册系列答案
相关题目
20.常温下、用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | B. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
1.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质,铜粉溶解的是( )
①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3.
①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3.
| A. | 只有①或② | B. | 只有②或④ | C. | 只有①或②或③ | D. | ①②③④中任意一种 |
18.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在非金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 最外层电子数为8的粒子是稀有气体元素的原子 |
15.下列有关反应限度的叙述正确的是( )
| A. | 大多数化学反应在一定条件下都有一定的限度 | |
| B. | 化学反应在一定条件下达到限度时,正、逆反应速率都等于零 | |
| C. | 当某反应体系中气体压强不在改变时,该反应一定达到了反应限度 | |
| D. | 当某反应在一定条件下达到反应限度时,反应物和生成物的浓度一定相等 |
2.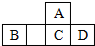 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )| A. | 简单氢化物的热稳定性:C>A | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 | |
| D. | 常温下它们的单质均为固态 |
19.为了测定“铁块”中铁元素的含量,实验流程如图所示:

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
(1)试剂A应选择C,试剂B应选择D(填序号)
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
11.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能( )
| A. | x+2 | B. | x+4 | C. | x+18 | D. | x+34 |