题目内容
19.已知常温下SO2与Na2O2之间可能发生两个反应,其中一个为2Na2O2+2SO2═2Na2SO3+O2(记为a),为验证二者到底是发生一个反应还是两个反应,某研究性学习小组的同学设计了如下图所示的实验装置进行研究,回答下列问题:
A B D.
(1)SO2与Na2O2之间可能发生的另一个反应是(记为b)Na2O2+SO2═Na2SO4.
(2)盛装Na2SO3的仪器名称是三颈烧瓶,其中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.实验开始时先打开弹簧夹通入一段时间的N2,目的是排除装置内空气,防止其产生干扰.
(3)若想通过检验装置D中所收集到的气体来判断反应a是否发生.
①请补画出装置D中相应的导管.
②为确保检验结论的可靠性,装置B中应盛放的试剂是无水氯化钙或五氧化二磷,且需要在C、D之间添加相应的装置,该装置的作用是吸收没有反应的二氧化硫.
(4)假设通过(3)中的操作证明反应a发生了,为确定反应b也发生了,实验中应持续通入气体至C中的现象为固体淡黄色完全消失;然后取适量的C中固体溶于蒸馏水,然后加入足量的盐酸,再加入适量的氯化钡溶液,得到白色沉淀(写出具体操作步骤).
分析 (1)过氧化钠具有强氧化性,可能与亚硫酸钠反应生成硫酸钠;
(2)根据仪器构造可知,盛放亚硫酸钠的仪器为三颈烧瓶;亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫气体和水;由于氧气能够氧化亚硫酸钠,干扰该实验,所以通入氮气排除装置中空气;
(3)①二氧化硫的密度大于空气,收集二氧化硫时需要采用长进短出的方式;
②由于水能够与过氧化钠反应,所以装置B用于干燥二氧化硫,可以盛放无水氯化钙或五氧化二磷;二氧化硫有毒,多余的气体需要吸收;
(4)假设通过(3)中的操作证明发生了b反应,需要先将过氧化钠完全消耗掉,此时淡黄色固体变成无色,然后通过检验固体含有硫酸根离子证明反应生成了硫酸钠.
解答 解:(1)类比过氧化钠与二氧化碳的反应可知,过氧化钠与二氧化硫的反应为:2Na2O2+2SO2═2Na2SO3+O2(记为a),由于亚硫酸钠容易被氧化,而过氧化钠具有强氧化性,则二者也可能发生反应:Na2O2+SO2═Na2SO4,
故答案为:Na2O2+SO2═Na2SO4;
(2)根据图示仪器构造可知,盛放Na2SO3的仪器名称为三颈烧瓶;亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫气体和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;由于氧气能够氧化亚硫酸钠,干扰该实验,所以通入氮气排除装置内空气,防止其产生干扰,
故答案为:三颈烧瓶;Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;排除装置内空气,防止其产生干扰;
(3)①由于二氧化硫的密度大于空气,所以收集二氧化硫时采用长导管进、短导管出的方式,补充完整后的装置图为: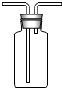 ,
,
故答案为: ;
;
②A产生的气体中混有水,而水能够与过氧化钠反应生成氧气,干扰实验检验,所以装置B的目的是干燥二氧化硫,可以盛放无水氯化钙或五氧化二磷;二氧化硫是一种有毒气体,多余的气体需要吸收,所以在C、D之间添加一个吸收没有反应的二氧化硫的装置,
故答案为:无水氯化钙或五氧化二磷;吸收没有反应的二氧化硫;
(4)假设通过(3)中的操作证明反应a发生了,为确定反应b也发生了,实验中应持续通入气体至C中过氧化钠完全反应,此时淡黄色固体的颜色消失;
然后将反应后的固体溶于蒸馏水,加入足量的盐酸,将亚硫酸钠完全除掉,再加入适量的硫酸钡溶液,得到白色沉淀,证明固体中含有硫酸根离子,从而证明反应b也发生了,
故答案为:固体淡黄色完全消失;溶于蒸馏水,然后加入足量的盐酸,再加入适量的氯化钡溶液,得到白色沉淀.
点评 本题考查了性质实验方案设计,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握常见物质的性质及检验方法,明确性质实验方案设计与评价原则.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在非金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 最外层电子数为8的粒子是稀有气体元素的原子 |

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
 滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.(1)测定NaOH和Na2CO3的混合液中NaOH的含量.实验操作为:先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂).
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为溶液的颜色由红色变为浅红色,为何此种情况能测出NaOH的含量?能,酚酞的变色在碱性范围内,此时只有NaOH与HCl反应.
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?不能,滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量.准确称取5.0000g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI═3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250mL,然后用5.0×10-4mol•L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+
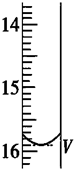
2S2O32-═2I-+S4O62-).取用Na2S2O3标准溶液应该用碱式式滴定管.有关实验数值如表(第一次滴定终点的数据如图所示,请将读得的数据填入表中).
| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | V=15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水.
| A. | (m-x)n | B. | W(m-x-n)n | C. | $\frac{W}{m}$(m-x+n) | D. | $\frac{m-x+n}{mW}$ |
| A. | x+2 | B. | x+4 | C. | x+18 | D. | x+34 |
| A. | CCl2═CH2 | B. | CH3-CH═CH2 | C. | CH3-CH═CH-CH3 | D. | CH2═CH-CH2-CH3 |
 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.