题目内容
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
则5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
温度降低时,反应①的平衡常数将______________(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=__________________________。
(3)碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g)![]() WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。

① 该反应△H____________0(填“>”或“<”)。
② 反应从开始到t1(t1= 3 min)时间内 I2 的平均反应速率v(I2)=_________。
③ 在450℃时,该反应的平衡常数K的值为__________________。
④ 能够说明上述反应已经达到平衡状态的有________________ (填选项字母)。
A.I2与WI2的浓度相等 B. 容器内各气体的浓度不再改变
C. 容器内混合气体的密度不再改变 D.容器内气体压强不发生变化
【答案】 -2017 kJ mol-1 增大 c(I42-)/c2(I-) < 0.012mol·L-1·min-1 9 BC
【解析】(1)已知:①2I2(s)+5O2(g)=2I2O5(s)ΔH=—1966 kJmol-1,②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1,根据盖斯定律,将②×![]() -①×
-①×![]() 得:5CO(g)+I2O5(s)=5CO2(g)+I2(s) △H=(—1200 kJmol-1)×
得:5CO(g)+I2O5(s)=5CO2(g)+I2(s) △H=(—1200 kJmol-1)×![]() -(—1966 kJmol-1)×
-(—1966 kJmol-1)×![]() = -2017 kJ mol-1,故答案为:-2017 kJ mol-1;
= -2017 kJ mol-1,故答案为:-2017 kJ mol-1;
(2)已知反应①的△H<0,所以降低温度平衡向正方向移动,则平衡常数增大;已知方程式I2(s)+2I-(aq)I42-,则其平衡常数表达式为:K=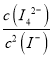 ;故答案为:增大;
;故答案为:增大; 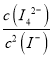 ;
;
(3)①(1)升高温度,化学平衡向吸热方向移动;升高温度时,WI2的物质的量减少,所以该反应向逆反应方向移动,即逆反应是吸热反应,所以正反应是放热反应,△H<0,故答案为:<;
(2)因为v(WI2)= 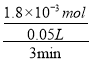 =1.20×10-2molL-1min-1;由于反应速率之比等于计量数之比,所以v(I2)=1.20×10-2molL-1min-1,故答案为:1.20×10-2molL-1min-1;
=1.20×10-2molL-1min-1;由于反应速率之比等于计量数之比,所以v(I2)=1.20×10-2molL-1min-1,故答案为:1.20×10-2molL-1min-1;
(3)反应开始时,碘的物质的量为n=![]() =0.002mol,反应达平衡时生成WI21.80×10-3mol,根据化学方程式可知,需要碘1.80×10-3mol参加反应,剩余碘0.0002mol,所以平衡时,c(WI2)=
=0.002mol,反应达平衡时生成WI21.80×10-3mol,根据化学方程式可知,需要碘1.80×10-3mol参加反应,剩余碘0.0002mol,所以平衡时,c(WI2)= ![]() =3.6×10-2mol/L,c(I2)=
=3.6×10-2mol/L,c(I2)= ![]() =0.004mol/L,因为W是固体,所以K=
=0.004mol/L,因为W是固体,所以K=![]() =9,故答案为:9;
=9,故答案为:9;
(4)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化。A、反应达平衡时,I2与WI2的浓度可能相等也可能不等,与反应初始浓度及转化率有关,所以不能证明达到平衡状态,故A错误;B、容器内各气体的浓度不再改变,表示反应的正逆反应速率相等,所以达到平衡状态,故B正确;C、平衡时各种物质的物质的量,即质量也不变,容器的体积不变,所以密度不再变化,故C正确;D、该反应是反应前后气体体积不变的反应,无论反应是否达到平衡状态,压强始终不变,故D错误;故答案为:BC。

【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是强酸的酸式盐,在水溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2).AlCl3是强酸弱碱盐,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3
Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
(3).实验室配制FeSO4溶液,因亚铁离子发生水解:Fe2++2H2O![]() Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O
Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,则Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,则Kw=1.0×10-12,故答案为:1.0×10-12;
②在该温度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,两溶液混合后氢氧根离子过量,所得溶液中c(OH-)=![]() = 0.1mol/L,则c(H+)=
= 0.1mol/L,则c(H+)=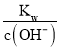 =10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
=10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
【题型】综合题
【结束】
24
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
【题目】在 1.0 L 密闭容器中放入 0.10molA(g),在一定温度进行如下反应:A(g)![]() 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
时间 t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P /P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)该平衡常数的表达式为_____________。
(2)下列能提高 A 的转化率的是________。
A.升高温度 B.体系中通入 A 气体 C.将 D 的浓度减小
D.通入稀有气体 He,使体系压强增大到原来的 5 倍
E.若体系中的 C 为 HCl,其它物质均难溶于水,滴入少许水
(3)前 2小时 C 的反应速率是___________ mol.L-1.h-1;
(4)平衡时 A 的转化率___________ C 的体积分数_________(均保留两位有效数字)