题目内容
【题目】在 1.0 L 密闭容器中放入 0.10molA(g),在一定温度进行如下反应:A(g)![]() 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
时间 t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P /P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)该平衡常数的表达式为_____________。
(2)下列能提高 A 的转化率的是________。
A.升高温度 B.体系中通入 A 气体 C.将 D 的浓度减小
D.通入稀有气体 He,使体系压强增大到原来的 5 倍
E.若体系中的 C 为 HCl,其它物质均难溶于水,滴入少许水
(3)前 2小时 C 的反应速率是___________ mol.L-1.h-1;
(4)平衡时 A 的转化率___________ C 的体积分数_________(均保留两位有效数字)
【答案】 K=![]() A E 0.02mol.L-1.h-1 70% 29%
A E 0.02mol.L-1.h-1 70% 29%
【解析】(1)反应A(g)![]() 2B(g)+C(g)+D(s)的平衡常数的表达式为K=
2B(g)+C(g)+D(s)的平衡常数的表达式为K=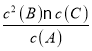 ;(2)A.升高温度,平衡正向移动,所以A的转化率增大,选项A正确;B.体系中通入A气体,A的转化率减小,选项B错误;C.将D(固体)的浓度减小,不会引起平衡的移动,A的转化率不变,选项C错误;D.通入稀有气体He,使体系压强增大到原来的5倍,但是各组分浓度不变,不会引起平衡的移动,A的转化率不变,选项D错误;E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水,则压强减小,平衡正向移动,所以A的转化率增大,选项E正确;答案选AE;
;(2)A.升高温度,平衡正向移动,所以A的转化率增大,选项A正确;B.体系中通入A气体,A的转化率减小,选项B错误;C.将D(固体)的浓度减小,不会引起平衡的移动,A的转化率不变,选项C错误;D.通入稀有气体He,使体系压强增大到原来的5倍,但是各组分浓度不变,不会引起平衡的移动,A的转化率不变,选项D错误;E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水,则压强减小,平衡正向移动,所以A的转化率增大,选项E正确;答案选AE;
(3)在1.0L密闭容器中放入0.10mol A(g),设A的变化量是x,则
A(g)2B(g)+C(g)+D(s)
初始量:0.1 0 0
变化量:x 2x x
末态量:0.1-x 2x x
则![]() =
=![]() ,解得x=0.04mol,所以前2小时A的反应速率是v=
,解得x=0.04mol,所以前2小时A的反应速率是v=![]() =
= =0.02mol.L-1.h-1,物质表示的反应速率之比等于系数之比,所以C表示的反应速率为:0.02 mol.L-1.h-1;
=0.02mol.L-1.h-1,物质表示的反应速率之比等于系数之比,所以C表示的反应速率为:0.02 mol.L-1.h-1;
(4)设:平衡时A的变化量是y,
A(g)2B(g)+C(g)+D(s)
初始量:0.1 0 0
变化量:y 2y y
平衡量:0.1-y 2y y
化学反应在20h时建立平衡,所以![]() =2.4,解得y=0.07mol,所以平衡时A的转化率=
=2.4,解得y=0.07mol,所以平衡时A的转化率=![]() ×100%=70%,C的体积分数=
×100%=70%,C的体积分数=![]() ×100%=
×100%=![]() ×100%=
×100%=![]() ×100%=29%。
×100%=29%。






