题目内容
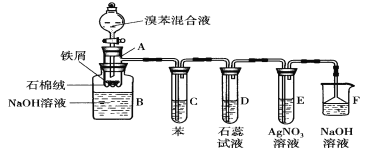
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
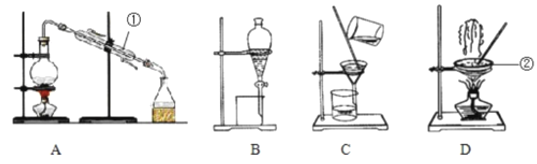
(1)除去自来水中的Ca2+、Mg2+、Cl-、SO42-等杂质,选择装置___(填代表装置图的字母)。
(2)用CCl4萃取碘水中的I2,有机层的颜色为___。
(3)装置A中①的名称是___,进水的方向是___,装置B在分液时为使液体顺利滴下,应进行的具体操作是___。
(4)海水中蕴藏着丰富的资源。在实验室中取少量海水,进行如下流程的实验: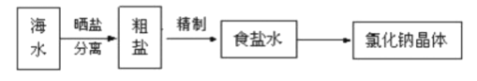
问题:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液④调节溶液的pH等于7:⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是___(填写字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤③②①⑥④⑦ d.⑤②①③⑥④⑦
【答案】A 紫红色 冷凝管 下进上出 打开分液漏斗上方玻璃塞或使玻璃塞凹槽对准漏斗小孔 a、c
【解析】
(1)除去自来水中的Cl-等杂质制取蒸馏水,可用蒸馏的方法;
(2)碘在有机溶剂中的溶解度较大,溶液为紫红色;
(3)根据仪器的结构特点和用途可确定仪器的名称;装置B在分液时为使液体顺利滴下,应使分液漏斗内压强与外界气压相等;
(4)把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除Fe3+用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉。
(1)除去自来水中的Cl-等杂质制取蒸馏水,可用蒸馏的方法,故选装置A。
(2)碘在有机溶剂中的溶解度较大,碘的四氯化碳溶液为紫红色;
(3)装置A中①的名称是冷凝管,下口进水,上口出水;装置B在分液时为使液体顺利滴下,应使分液漏斗内压强与外界气压相等,具体操作为应先将分液漏斗上的活塞拿下后再打开旋塞放出液体或者使分液漏斗活塞上的凹槽对准分液漏斗口上的小孔后再打开旋塞放出液体;
(4)除去粗盐中的可溶性杂质:Mg2+、Ca2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子和多余的钡离子):Ca2++CO32-=CaCO3,CO32-+Ba2+=BaCO3↓,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序;过滤后,滤液中加入盐酸,然后调节溶液的pH等于7后蒸发即可,即顺序为a.⑤②③①⑥④⑦;c.⑤③②①⑥④⑦;选ac。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案