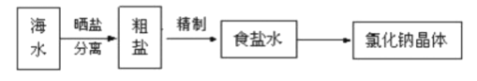
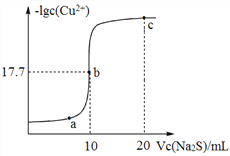
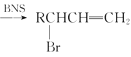题目内容
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
请回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)_________L。
(2)反应②中_________作氧化剂,___________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________。
(4)用单线桥法表示反应③电子转移的方向和数目。KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
______________
(5)反应③中盐酸表现_________________性。
【答案】147 33.6 H2SO4 CuSO4 0.5mol  酸性和还原
酸性和还原
【解析】
(1)反应①Fe+H2SO4(稀)=FeSO4+H2↑中,Fe元素化合价从0价升高为+2价,即溶解1molFe转移2mol电子,则当反应①转移3摩尔电子时,消耗H2SO4和生成氢气的物质的量均为1.5mol,硫酸质量是1.5mol×98g/mol=147g,产生氢气的体积(标准状况)为1.5mol×22.4L/mol=33.6L;
(2)反应②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑中S元素从+6价降为+4价,则硫酸被还原,作氧化剂,Cu是还原剂,CuSO4是氧化产物;
CuSO4+2H2O+SO2↑中S元素从+6价降为+4价,则硫酸被还原,作氧化剂,Cu是还原剂,CuSO4是氧化产物;
(3)11.2LSO2气体(标准状况下)的物质的量为![]() =0.5mol,则反应②Cu+2H2SO4(浓)
=0.5mol,则反应②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑中生成0.5molSO2气体时,被还原的H2SO4的物质的量是0.5mol;
CuSO4+2H2O+SO2↑中生成0.5molSO2气体时,被还原的H2SO4的物质的量是0.5mol;
(4)反应中KClO3为氧化剂,得电子,HCl为还原剂,失电子,由化合价的变化可知转移电子方向和数目可表示为 ;
;
(5)反应③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中Cl元素部分从-1价升高为0价,则盐酸表现酸性和还原性;

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)===2NH3(g) △H=-92.4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收 c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 |
|
|
|
下列说法正确的是( )
A. 2c1>c3B. a+b=92.4C. 2p2<p3D. ![]() 1+
1+![]() 3>1
3>1