题目内容
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是( )
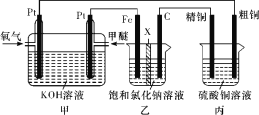
A.通入甲醚的一极为负极,发生的电极反应为:CH3OCH3-12e-+16OH- =2CO32-+11H2O
B.乙装置中铁电极为阴极,电极反应式为Fe-2e-= Fe2+
C.反应一段时间后,乙装置中生成的氢氧化钠在石墨极区
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
【答案】A
【解析】
根据图象可知,装置甲为原电池装置,乙、丙为电解池装置,通入甲醚的一极失电子作原电池的负极,则乙池中Fe为阴极,丙池中精铜作阴极;
A.通入甲醚的一极为负极,溶液呈碱性,则生成碳酸根离子,发生的电极反应为:CH3OCH3-12e-+16OH-=2CO32-+11H2O,A正确;
B.乙装置中铁电极为阴极,水电离出的氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,B错误;
C.反应一段时间后,乙装置中生成的氢氧化钠在Fe电极区,C错误;
D.丙装置为电解精炼铜,反应一段时间后,粗铜中的Zn、Fe等杂质溶解,阴极始终析出铜,所以硫酸铜溶液浓度减小,D错误;
答案为A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目