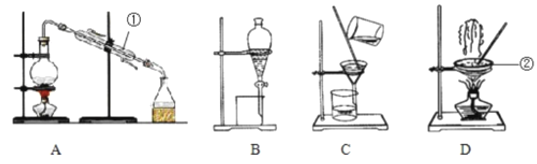
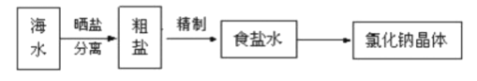
题目内容
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;5 min后反应达到平衡,M的转化率为60%,此时N的转化率为________;用M表示的反应速率为________;该温度下反应的平衡常数K=________。
(2)若反应温度升高,M的转化率________(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=c(N)=2 mol·L-1,a=________。
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为________。
【答案】25% 0.12 mol·(L·min)-1 0.5 增大 6 41%
【解析】
(1)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算;
(2)依据温度对化学平衡的影响判断;
(3)化学平衡三段式列式计算起始浓度;
(4)依据化学平衡三段式列式计算,依据转化率的概念计算得到。
(1) 由题意建立如下三段式:
M(g)+ N(g)![]() P(g)+ Q(g)
P(g)+ Q(g)
起始量(mol/L) 1 2.4 0 0
变化量(mol/L)1×0.6=0.6 0.6 0.6 0.6
平衡量(mol/L)0.4 1.8 0.6 0.6
N的转化率为α(N)=![]() ×100%=
×100%=![]() ×100%=25%,用M表示的反应速率υ(M)=
×100%=25%,用M表示的反应速率υ(M)=![]() =
=![]() =0.12 mol·(L·min)-1;该温度下化学平衡常数K=
=0.12 mol·(L·min)-1;该温度下化学平衡常数K=![]() =
=![]() =0.5,故答案为:25%;0.12 mol·(L·min)-1;0.5;
=0.5,故答案为:25%;0.12 mol·(L·min)-1;0.5;
(2)因为该反应热是吸热反应,升高温度,平衡向正反应方向移动,则M的转化率增大,故答案为:增大;
(3) 由题意建立如下三段式:
M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始浓度(mol·L-1): 4 a 0 0
转化浓度(mol·L-1): 2 2 2 2
平衡浓度(mol·L-1): 2 a-2 2 2
由温度不变,平衡常数不变可得K=![]() =0.5,解得得a=6,故答案为:6;
=0.5,解得得a=6,故答案为:6;
(4) 由题意建立如下三段式:
M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始浓度(mol·L-1): b b 0 0
转化浓度(mol·L-1): x x x x
平衡浓度(mol·L-1): (b-x) (b-x) x x
由温度不变,平衡常数不变可得K=![]() =0.5,解得x=0.41b,则M的转化率为α(M)=
=0.5,解得x=0.41b,则M的转化率为α(M)=![]() ×100%=
×100%=![]() ×100%= 41%,故答案为:41%。
×100%= 41%,故答案为:41%。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)===2NH3(g) △H=-92.4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收 c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 |
|
|
|
下列说法正确的是( )
A. 2c1>c3B. a+b=92.4C. 2p2<p3D. ![]() 1+
1+![]() 3>1
3>1
【题目】下表是元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
(1)①—⑩中,最活泼的金属元素是___________________(写元素符号);最不活泼的元素是_______(写元素符号)。
(2)④、⑤的简单离子,其半径更大的是________(写离子符号)。
(3)⑧、⑨的气态氢化物,更稳定的是_________(填化学式)。
(4)元素的非金属性:①_______⑦(填“>”或“<”)。
(5)①—⑨的最高价氧化物的水化物中:酸性最强的是___________(填化学式),既能与酸反应又能与碱反应的是___________(填化学式).