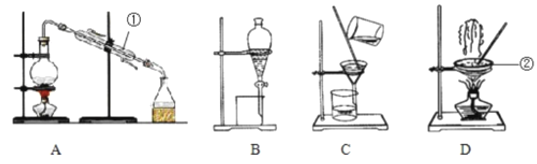
题目内容
【题目】有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)去除废气中H2S的相关热化学方程式如下:
2H2S(g)+3O2(g)=2H2O(l)+2SO2(g);ΔH=akJ·mol-1
2H2S(g)+SO2(g)=2H2O(l)+3S(s);ΔH=bkJ·mol-1
反应2H2S(g)+O2(g)=2H2O(l)+2S(s)的ΔH=__kJ·mol-1。
为了有效去除废气中的H2S,在燃烧炉中通入的H2S和空气(O2的体积分数约为20%)体积比一般控制在0.4,理由是__。
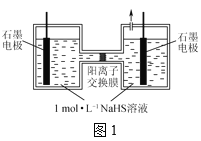
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物Sn2-,S n2-容易被继续氧化而生成硫单质。
①阳极HS-氧化为S n2-的电极反应式为___。
②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是___。
(3)用CO(NH2)2(N为-3价)水溶液吸收SO2,吸收过程中生成(NH4)2SO4和CO2。该反应中的氧化剂是__。
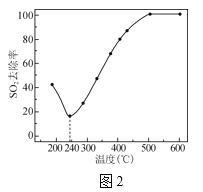
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。240℃以前,随着温度的升高,SO2去除率降低的原因是__。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是__。
【答案】![]() 如果H2S和空气体积比大于0.4,废气中H2S脱除效率低 nHS--2(n-1)e-+nOH=Sn2-+nH2O 阳极产生的硫覆盖在石墨电极表面,导致石墨电极导电性下降 O2 温度较低时,SO2能够被催化剂吸附。温度升高,吸附能力减弱 温度较高时,SO2在催化剂存在条件下被CO还原。温度升高,催化剂活性增强,反应速率加快
如果H2S和空气体积比大于0.4,废气中H2S脱除效率低 nHS--2(n-1)e-+nOH=Sn2-+nH2O 阳极产生的硫覆盖在石墨电极表面,导致石墨电极导电性下降 O2 温度较低时,SO2能够被催化剂吸附。温度升高,吸附能力减弱 温度较高时,SO2在催化剂存在条件下被CO还原。温度升高,催化剂活性增强,反应速率加快
【解析】
(1)设2H2S(g)+3O2(g)=2H2O(l)+2SO2(g)为①式,2H2S(g)+SO2(g)=2H2O(l)+3S(s)为②式,根据盖斯定律,目标方程式为![]() ,故ΔH=
,故ΔH=![]() kJ·mol-1;根据2H2S(g)+O2(g)=2H2O(l)+2S(s)可知, H2S与O2的比例为2:1,空气中O2占20%,故H2S与空气之比为2:5(即0.4)时可以完全反应。若大于0.4,H2S会有剩余,脱除效率低;
kJ·mol-1;根据2H2S(g)+O2(g)=2H2O(l)+2S(s)可知, H2S与O2的比例为2:1,空气中O2占20%,故H2S与空气之比为2:5(即0.4)时可以完全反应。若大于0.4,H2S会有剩余,脱除效率低;
(2)①阳极HS-失电子变成阳极HS-:nHS--2(n-1)e-+nOH=Sn2-+nH2O;
②阳极生成的Sn2-容易被继续氧化而生成硫单质,硫单质不导电,覆盖在石墨电极表面,导致石墨电极导电性下降;
(3)CO(NH2)2水溶液吸收SO2,生成(NH4)2SO4和CO2,S由+4价升为+6价,而C(+4价)、N(-3价)、H(+1价)都没有变价,所以氧化剂只能是O2;
(4)催化剂γ—Al2O3的比表面积大,具有吸附性,温度较低时(小于240℃),SO2能够被催化剂吸附,SO2含量降低,随着温度的升高催化剂的吸附能力减弱,导致催化剂吸附的SO2减少;
温度较高(大于240℃)时,发生反应2CO+SO2=2CO2+S ,SO2在催化剂存在条件下被CO还原。温度升高,催化剂活性增强,反应速率加快,SO2去除率增大;

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案