��Ŀ����
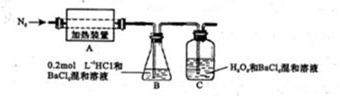
��������ҵ��ϴ�ֲ�ʱ�����ķ�Һ��Ҫ�ɷ�ΪFe2+��H+��Cl���������������������÷�Һ���������ᣬ�Ʊ�������Ϳ�ϡ�
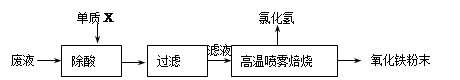
��1������X�Ļ�ѧʽ�� ��
��2���Ȼ�������Һ��������������ʱת��Ϊ�Ȼ����������������ĩ���йصĻ�ѧ����ʽΪ��
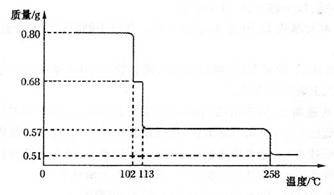
��3��ij������Ϳ�ϵijɷ��У�������Fe2O3�⣬��������CuO��FeO�е�һ�֡������ʵ��̽��������Ϳ�������ӵ����ʡ�
�������������
����1��������CuO�� ����2��������FeO��
�ڻ��ڼ��� ���1����2���������ʵ�鷽��������ʵ�顣�ڴ����д��ʵ�鲽�衢Ԥ������ͽ��ۡ�
��ѡʵ���Լ������ۡ�3mol?L��1H2SO4��0.01 mol?L��1����KMnO4��Һ��10%NaOH��Һ��10%H2O2��KSCN��Һ
��4����ˮ���ա������������ա�ʱ�������Ȼ�������ɵõ����ᡣ����㣺��1000gˮ�����ձ�״���¶������Ȼ�������ɵõ�36.5%��Ũ�����д��������̣����������ѧ����ʽ��ʾ�����ػ���

��1������X�Ļ�ѧʽ�� ��
��2���Ȼ�������Һ��������������ʱת��Ϊ�Ȼ����������������ĩ���йصĻ�ѧ����ʽΪ��
��3��ij������Ϳ�ϵijɷ��У�������Fe2O3�⣬��������CuO��FeO�е�һ�֡������ʵ��̽��������Ϳ�������ӵ����ʡ�
�������������
����1��������CuO�� ����2��������FeO��
�ڻ��ڼ��� ���1����2���������ʵ�鷽��������ʵ�顣�ڴ����д��ʵ�鲽�衢Ԥ������ͽ��ۡ�
��ѡʵ���Լ������ۡ�3mol?L��1H2SO4��0.01 mol?L��1����KMnO4��Һ��10%NaOH��Һ��10%H2O2��KSCN��Һ
| �������� | Ԥ������ͽ��� |
| ����1��ȡ������Ʒ���Թ��У�_________________ ____________________________________________ | ___________________________ |
| ����2�� ____________________________________________ | ___________________________ |
��4����ˮ���ա������������ա�ʱ�������Ȼ�������ɵõ����ᡣ����㣺��1000gˮ�����ձ�״���¶������Ȼ�������ɵõ�36.5%��Ũ�����д��������̣����������ѧ����ʽ��ʾ�����ػ���
��16�֣�
��1��Fe ��1�֣�
��2��FeCl2 + 2H2O Fe(OH)2 + 2HCl ��1�֣�
Fe(OH)2 + 2HCl ��1�֣�
4Fe(OH)2 + O2 +2H2O =" 4" Fe(OH)3 ��1�֣�
2Fe(OH)3 Fe2O3 + 3H2O ��1�֣�©д�������÷֣�
Fe2O3 + 3H2O ��1�֣�©д�������÷֣�
����4FeCl2+4H2O+O2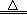 2 Fe2O3+8HCl ��3�֣�©д������2�֣�
2 Fe2O3+8HCl ��3�֣�©д������2�֣�
��3������1 ��1�֣�
������ÿ��2�֣���8�֣�
������˵��������1��δ�ӡ��������͡��������1�֡�
����2�з���Ϊ��������10%NaOH��Һ�����������ɫ������˵����������CuO��������2�ͽ��۵�0�֣���Ϊ��Fe3+��H+���ţ���һ���ܹ۲쵽��ɫ������
����2 ��1�֣�
������˵��������1��δ�ӡ��������͡��������1�֡�
����2�У���KSCN��H2O2����ϼ���Fe2+������2�ͽ��۵�0�֣���Ϊ�� Fe3+���š�
��4����3�֣��������HCl���ΪxL����
(36.5x/22.4)/(1000+ 36.5x/22.4) ��100%=36.5% ��2�֡���ȷ��ʽ��2�֣�
���x= 22400/63.5(L)=352.89(L) ��1�֣�������ȷ�Ĵ�Ҳ�÷֣�
��1��Fe ��1�֣�
��2��FeCl2 + 2H2O
 Fe(OH)2 + 2HCl ��1�֣�
Fe(OH)2 + 2HCl ��1�֣�4Fe(OH)2 + O2 +2H2O =" 4" Fe(OH)3 ��1�֣�
2Fe(OH)3
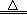 Fe2O3 + 3H2O ��1�֣�©д�������÷֣�
Fe2O3 + 3H2O ��1�֣�©д�������÷֣�����4FeCl2+4H2O+O2
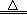 2 Fe2O3+8HCl ��3�֣�©д������2�֣�
2 Fe2O3+8HCl ��3�֣�©д������2�֣���3������1 ��1�֣�
������ÿ��2�֣���8�֣�
| ʵ����� | Ԥ������ͽ��� |
| ����1������������3mol?L��1H2SO4������� | ��Ʒȫ���ܽ� |
| ����2��ȡ������Һ���Թ��У������������ۣ�������ټ�������3mol?L��1H2SO4������� | �Թ��г��ֺ�ɫ���壬˵����������CuO |
������˵��������1��δ�ӡ��������͡��������1�֡�
����2�з���Ϊ��������10%NaOH��Һ�����������ɫ������˵����������CuO��������2�ͽ��۵�0�֣���Ϊ��Fe3+��H+���ţ���һ���ܹ۲쵽��ɫ������
����2 ��1�֣�
| ʵ����� | Ԥ������ͽ��� |
| ����1������������3mol?L��1H2SO4������� | ��Ʒȫ���ܽ� |
| ����2��ȡ������Һ���Թ��У���μ���0.01 mol?L��1����KMnO4��Һ | ����Ϻ�ɫ��ȥ��˵����������FeO�� |
������˵��������1��δ�ӡ��������͡��������1�֡�
����2�У���KSCN��H2O2����ϼ���Fe2+������2�ͽ��۵�0�֣���Ϊ�� Fe3+���š�
��4����3�֣��������HCl���ΪxL����
(36.5x/22.4)/(1000+ 36.5x/22.4) ��100%=36.5% ��2�֡���ȷ��ʽ��2�֣�
���x= 22400/63.5(L)=352.89(L) ��1�֣�������ȷ�Ĵ�Ҳ�÷֣�
�����������1�����ݳ�ȥ�����ʲ�����������ԭ��Fe+2H+=Fe2++H2������˳��Ჽ��ѡ��ĵ���Xһ���ǹ��������ۻ���м����2���Ȼ�������ǿ�������Σ���ˮ�⣬����ˮ�ⷴӦ�����ȷ�Ӧ����˸�����ʹ�䳹��ˮ�⣬�����������������Ȼ��⣻�Ȼ��������ݳ����������������ȶ������ױ������е���������Ϊ����������������������ʱ�ֽ⣬������������ˮ����������������Ӧ���Եõ��ܷ�Ӧʽ����3��������1������Fe2O3��CuO����������ˮ�ļ������������ֱ��ѡ���Լ�����CuO�Ĵ��ڣ�������������ϡ�����ܽ����������������ͭ��Һ���ٸ��ݽ������˳��������Ρ�ͭ�ε����ʣ�Fe+Fe2(SO4)3=3FeSO4��Fe+CuSO4=FeSO4+Cu����˼�����������ۣ���ַ�Ӧ��������ɫ���壬˵����Ʒ�к���CuO����ѡ��NaOH��Һ��۲���Һ����ɫ�����У���Ϊ�����Ӷ�ͭ���ӵļ�����ɸ��ţ�������2������Fe2O3��FeO����������ˮ�ļ������������ֱ��ѡ���Լ�����FeO�Ĵ��ڣ�������������ϡ�����ܽ����������������������Һ���ٸ����Ρ������ε����ʣ�������Һ����ʹ���Ը��������Һ��ɫ������������Һ���ܣ���ӦΪ5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O����˼����������Ը��������Һ����ַ�Ӧ����Һ��ɫ��˵����Ʒ�к���FeO������ѡ��KSCN��˫��ˮ���飬��Ϊ�����ӻ�����������ӵļ��飻��4���������HCl���ΪxL������n=V/22.4L?mol��1��m=n?M��m(��Һ)=m(����)+m(ˮ)��w(����)=m(����)/m(��Һ)��100%����(36.5x/22.4)/(1000+ 36.5x/22.4) ��100%="36.5%" �����x= 22400/63.5(L)=352.8(L)��

��ϰ��ϵ�д�
�����Ŀ