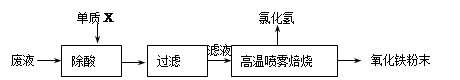
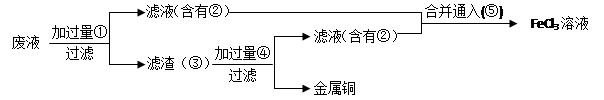
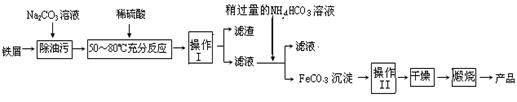
题目内容
将3.20 g Cu跟10.0 mol/L的硝酸30.0 mL充分反应,还原产物中有NO和NO2 。若反应后溶液中有a mol H+,则此时溶液中NO3- 的物质的量为
| A.a/2 mol | B.2a mol | C.0.100 a mol | D.(a + 0.100) mol |
D
试题分析:由守恒关系可知:铜最终只能转化成硝酸铜,3.20 g Cu的物质的量是0.05mol,所以硝酸铜中的硝酸根是0.1mol。根据氢元素守恒可得,为何铜离子结合的硝酸根是a mol,所以溶液中NO3- 的物质的量为(a + 0.100) mol,故选D。
点评:本题重点考查的是有关硝酸氧化性的知识,考查学生对课本知识的掌握情况和计算能力。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目