题目内容
I.铁是人体必须的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成份。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是 ;实验室在配制FeSO4溶液时常加入 以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化 。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是 。
②计算上述产品中FeSO4·7H2O的质量分数为 。
II.硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因 。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。
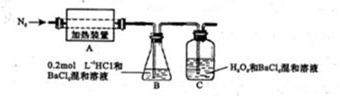
①A中固体充分加热较长时间后,通入氮气,目的是 。
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为 。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是 ;实验室在配制FeSO4溶液时常加入 以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化 。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是 。
②计算上述产品中FeSO4·7H2O的质量分数为 。
II.硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因 。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是 。
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为 。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)
(16分)I.(1)12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+(其它合理答案也给分)(2分);
铁粉(1分);取少量FeSO4溶液置于试管中,加数滴KSCN溶液,如果溶液变红,则说明FeSO4溶液已被氧化,如不变红,则说明FeSO4溶液没有被氧化。(2分)
(2)①当最后一滴酸性高锰酸钾溶液滴入锥形瓶恰好出现浅紫红色,半分钟内不褪色,说明达到终点。(2分) ②97.54%(3分)
Ⅱ.(3)硫酸亚铁铵溶液中NH4+水解增大c(H+),抑制了上述氧化还原反应的进行。(2分)
(4)①使分解产生的气体在B和C中被吸收充分(1分)②溶液变混浊或出现白色沉淀(1分)
③SO2+H2O2+Ba2+=BaSO4↓+2H+或SO2+H2O2=SO42-+2H+、SO42-+Ba2+=BaSO4↓(2分)
铁粉(1分);取少量FeSO4溶液置于试管中,加数滴KSCN溶液,如果溶液变红,则说明FeSO4溶液已被氧化,如不变红,则说明FeSO4溶液没有被氧化。(2分)
(2)①当最后一滴酸性高锰酸钾溶液滴入锥形瓶恰好出现浅紫红色,半分钟内不褪色,说明达到终点。(2分) ②97.54%(3分)
Ⅱ.(3)硫酸亚铁铵溶液中NH4+水解增大c(H+),抑制了上述氧化还原反应的进行。(2分)
(4)①使分解产生的气体在B和C中被吸收充分(1分)②溶液变混浊或出现白色沉淀(1分)
③SO2+H2O2+Ba2+=BaSO4↓+2H+或SO2+H2O2=SO42-+2H+、SO42-+Ba2+=BaSO4↓(2分)
试题分析: I.(1)亚铁离子具有还原性,极易被氧化生成铁离子,进而生成氢氧化铁沉淀,反应的离子方程式是12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+;由于亚铁离子极易被氧化生成铁离子,所以实验室在配制FeSO4溶液时常加入铁粉以防止其被氧化;亚铁离子易被氧化生成铁离子,可以通过检验铁离子来检验硫酸亚铁是否被氧化,即取少量FeSO4溶液置于试管中,加数滴KSCN溶液,如果溶液变红,则说明FeSO4溶液已被氧化,如不变红,则说明FeSO4溶液没有被氧化。
(2)①由于酸性高锰酸钾溶液显紫红色,所以用硫酸酸化的KMnO4滴定终点的标志是当最后一滴酸性高锰酸钾溶液滴入锥形瓶恰好出现浅紫红色,半分钟内不褪色,说明达到终点。
②消耗高锰酸钾的物质的量是0.01mol/L×0.04L=0.0004mol。反应中锰元素的化合价从+7价降低到+2价,得到5个电子,铁元素的化合价从+2价升高到+3价,失去1个电子,所以根据电子的得失守恒可知,25ml溶液中硫酸亚铁的物质的量是0.0004mol ×5=0.002mol。所以产品中FeSO4·7H2O的质量分数为
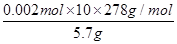 ×100%=97.54%。
×100%=97.54%。Ⅱ.(3)由于硫酸亚铁铵在溶液中电离出的NH4+水解,溶液显酸性增大c(H+),抑制了上述氧化还原反应的进行,所以硫酸亚铁铵不易被氧化。
(4)①由于硫酸亚铁铵加热分解生成气体被装置B和C吸收,所以通入氮气的目的是使分解产生的气体在B和C中被吸收充分。
②三氧化硫溶于水生成硫酸,进而生成硫酸钡白色沉淀。所以若含有该气体,观察到的观象为溶液变混浊或出现白色沉淀。
③双氧水具有强氧化性,如果C中有白色沉淀生成,这说明反应中有SO2生成,SO2被双氧水氧化生成硫酸,进而生成硫酸钡白色沉淀,所以C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+或SO2+H2O2=SO42-+2H+、SO42-+Ba2+=BaSO4↓。42-检验;试剂的配制、滴定实验终点判断;物质含量的测定和计算;氧化还原反应方程式的书写等

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目

 4Fe3++2H2O
4Fe3++2H2O