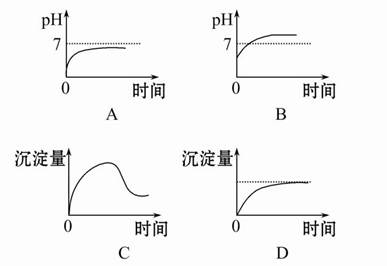
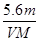题目内容
将0.2 mol AgNO3、0.4 mol Cu(NO3)2、0.6 mol KCl溶于水,配成100 mL溶液,用石墨电极电解一段时间后,若在一极析出0.3 mol Cu,试计算另一极上产生的气体体积(标准状况)。
5.6 L
试题分析:三种物质溶于水时,AgNO3与KCl反应后溶液中含有0.2 mol KNO3、0.4 mol Cu(NO3)2和0.4 mol KCl。当有0.3 mol Cu生成时,先后发生反应:
Cu2++2Cl-
 Cu+Cl2↑①
Cu+Cl2↑①2Cu2++2H2O
 2Cu+O2↑+4H+②
2Cu+O2↑+4H+②在阳极上先后生成Cl2和O2。n(Cl2)=1/2n(KCl)=(1/2)×0.4 mol=0.2 mol,根据电子守恒有:0.3 mol×2=0.2 mol×2+4n(O2),解得n(O2)=0.05 mol,所以阳极共产生气体体积为:(0.2 mol+0.05 mol )×22.4 L·mol-1=5.6 L。

练习册系列答案
相关题目
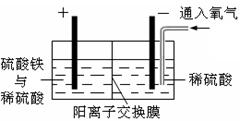
 R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。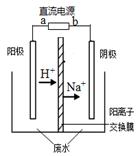
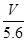 NA
NA