题目内容
以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
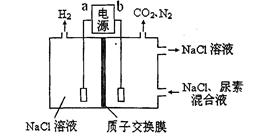
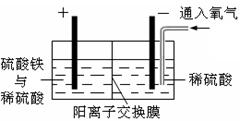
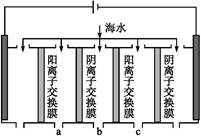
Ⅱ.采用如图所示装置进行电化学浸出实验。将精选黄铜矿粉加入电解槽的阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:CuFeS2 + 4H+=Cu2+ + Fe2+ + 2H2S↑ 2Fe3+ + H2S=2Fe2+ + S↓+ 2H+ ,阳极区硫酸铁的主要作用是 。(2)阴极区,电极上开始时有大量气泡产生,后有红色固体析出,一段时间后红色固体溶解。写出析出红色固体的反应方程式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。

Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如图所示装置进行电化学浸出实验。将精选黄铜矿粉加入电解槽的阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)
 R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:CuFeS2 + 4H+=Cu2+ + Fe2+ + 2H2S↑ 2Fe3+ + H2S=2Fe2+ + S↓+ 2H+ ,阳极区硫酸铁的主要作用是 。(2)阴极区,电极上开始时有大量气泡产生,后有红色固体析出,一段时间后红色固体溶解。写出析出红色固体的反应方程式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。
(1)吸收硫化氢气体,防止环境污染(表述合理即可得分) (1分)
(2)Cu2++2e–=Cu (2分) (3)分液漏斗 (1分)
(4)增大H+浓度,使平衡2RH(有机相) + Cu2+(水相) R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生 (2分) (5)c(H+)>c(SO42–)>c(Cu2+)>c(OH–) (2分)
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生 (2分) (5)c(H+)>c(SO42–)>c(Cu2+)>c(OH–) (2分)
(2)Cu2++2e–=Cu (2分) (3)分液漏斗 (1分)
(4)增大H+浓度,使平衡2RH(有机相) + Cu2+(水相)
 R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生 (2分) (5)c(H+)>c(SO42–)>c(Cu2+)>c(OH–) (2分)
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生 (2分) (5)c(H+)>c(SO42–)>c(Cu2+)>c(OH–) (2分)试题分析:(1)反应CuFeS2 + 4H+=Cu2+ + Fe2+ + 2H2S↑中有H2S气体产生,H2S有毒属于大气污染物。根据反应2Fe3+ + H2S=2Fe2+ + S↓+ 2H+ 可知,阳极区硫酸铁的主要作用是吸收硫化氢气体,防止环境污染。
(2)电解池中阴极得到电子,发生还原反应。阴极析出红色固体,说明该红色固体是铜,因此电极反应式为Cu2++2e–=Cu。
(3)有机物不溶于水,分液即可,所以分离有机相和水相的主要实验仪器是分液漏斗。
(4)加入硫酸,增大溶液中H+浓度,使平衡2RH(有机相) + Cu2+(水相)
 R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生。
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生。(5)200mL0.5 mol/L的CuSO4溶液中硫酸铜的物质的量=0.2L×0.5mol/L=0.1mol,生成铜3.2 g,物质的量=3.2g÷64g/mol=0.05mol。这说明反应中硫酸铜还有0.05mol没有被电解。根据方程式2CuSO4+2H2O
 2Cu+2H2SO4+O2↑可知,溶液中还生成0.05mol硫酸。由于铜离子水解,则溶液中离子浓度大小顺序是)c(H+)>c(SO42–)>c(Cu2+)>c(OH–)。
2Cu+2H2SO4+O2↑可知,溶液中还生成0.05mol硫酸。由于铜离子水解,则溶液中离子浓度大小顺序是)c(H+)>c(SO42–)>c(Cu2+)>c(OH–)。
练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
 KIO3+3H2↑
KIO3+3H2↑ 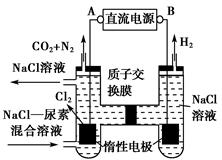
 H2 ↑
H2 ↑