题目内容
20.有关碱金属单质的叙述正确的是( )| A. | 都可以保存在煤油中 | B. | 随电子层数增加,熔沸点逐渐降低 | ||
| C. | 都是银白色金属,质软,有延展性 | D. | 随电子层数增加,密度逐渐增大 |
分析 A.锂的密度小于煤油;
B.碱金属从上到下,原子半径依次增大,金属键依次减弱;
C.铯是金黄色;
D.钠的密度大于钾.
解答 解:A.锂的密度小于煤油,浮在煤油表面,不能隔绝空气,故A错误;
B.碱金属从上到下,原子半径依次增大,金属键依次减弱,熔沸点依次减弱,故B正确;
C.铯是金黄色,不是银白色,故C错误;
D.碱金属随着原子序数的增加,单质的密度增大,但是钾反常,故D错误;
故选:B.
点评 本题考查了碱金属单质的性质,明确同主族性质递变规律是解题关键,题目难度不大.

练习册系列答案
相关题目
9.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下).它在光照的条件下与氯气反应能生成3种不同的一氯取代物.该烃的结构简式是( )
| A. | 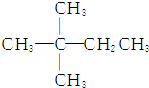 | B. | CH3CH2CH2CH2CH3 | ||
| C. | 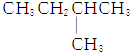 | D. | 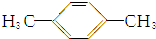 |
15.下列物质中,含有非极性共价键的是( )
| A. | CaCl2 | B. | CO2 | C. | Na2O2 | D. | CH4 |
12.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组成( )
| A. | Al3+、CH3COO-(醋酸根)、Cl- | B. | Na+、NH4+、Cl- | ||
| C. | Mg2+、Cl-、Fe2+ | D. | Mg2+、Ba2+、Br- |
9.下列各轨道按能量由低到高顺序排列,不正确的是( )
| A. | 4s 3d 5s | B. | 5s 4d 5p | C. | 3px3d4s | D. | 3d 4p 4f |