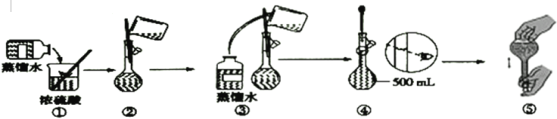
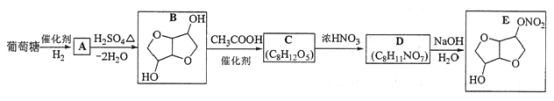
题目内容
【题目】某化学兴趣小组在家中进行化学实验,按照图A连接好线路发现灯泡不亮,按照图B连接好线路发现灯泡亮.
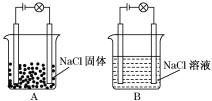
依据上述现象判断或回答下列问题:
(1)NaCl属于________(“酸”、“碱”或“盐”),因为__________________________.
(2)NaCl固体________(填“能”或“不能”)导电,原因是_____________________.
(3)NaCl溶液________(填“能”或“不能”)导电,原因是__________________.
(4)在NaCl固体、NaCl溶液中属于电解质的是_________________________________,
原因是____________________________________.
【答案】盐 NaCl是由金属阳离子和酸根离子构成的化合物 不能 NaCl未电离 能 NaCl溶液中有能自由移动的离子 NaCl固体 NaCl固体是化合物,且其水溶液可导电
【解析】
由酸根离子和金属阳离子或NH4+构成的化合物是盐;含有自由移动离子或电子的物质能导电,在水溶液里或熔融状态下能导电的化合物是电解质,据此分析解答。
(1)NaCl是由金属阳离子Na+和酸根离子Cl-构成,即NaCl属于盐;
(2)NaCl固体不含自由移动的离子或电子,因此NaCl固体不能导电;
(3)NaCl在水溶液里电离出自由移动的Na+和Cl-,因此NaCl溶液能够导电;
(4)NaCl是在水溶液里或熔融状态下能电离出自由移动的离子的化合物,属于电解质,NaCl溶液属于混合物,既不是电解质也不是非电解质。

 阅读快车系列答案
阅读快车系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
I.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_______________作指示剂。
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为____________mL。

(4)滴定。当____________时,停止滴定,并记录NaOH溶液的最终读数.再重复滴定3次。
Ⅱ.实验记录
实验数据(mL) 滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理:
(5)某同学在处理数据时计算得:平均消耗的NaOH溶液的体积 V=![]() =15.24mL。指出他的计算的不合理之处:____________________________________。按正确数据处理,可得市售白醋总酸量=____________g/100mL。(结果保留四位有效数字)
=15.24mL。指出他的计算的不合理之处:____________________________________。按正确数据处理,可得市售白醋总酸量=____________g/100mL。(结果保留四位有效数字)
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)____________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出