题目内容
【题目】将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
【答案】C
【解析】
0.4gNaOH的物质的量为0.01mol,1.06gNa2CO3的物质的量也为0.01mol,NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生NaOH+HCl=NaCl+H2O,再发生Na2CO3+HCl=NaCl+NaHCO3,最后发生NaHCO3+HCl=NaCl+CO2↑+H2O,此时才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答。
0.4gNaOH物质的量为0.4g÷40g/mol=0.01mol,1.06gNa2CO3物质的量为1.06g÷106g/mol=0.01mol;向NaOH和Na2CO3混合溶液中滴加盐酸时,首先NaOH与HCl反应生成水和氯化钠,0.01molNaOH消耗0.01molHCl,滴入0.1L盐酸时,两者恰好反应完全;继续滴加盐酸,发生反应Na2CO3+HCl=NaCl+NaHCO3,此过程不产生气体,当再加入0.1L盐酸时,0.01mol碳酸钠恰好完全转化成0.01mol碳酸氢钠;继续滴加盐酸,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,此过程中放出气体,再加入0.1L盐酸时,碳酸氢钠恰好完全反应,产生0.01mol二氧化碳,对照各选项,答案选C。

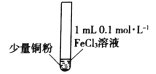
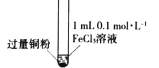
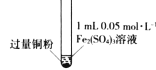
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀