题目内容
【题目】下列化学用语对事实的表述不正确的是( )
A.电解精炼铜的阴极反应:Cu2+ +2e=Cu
B.常温时,0.1mol/L氨水的pH=11.1:NH3·H2O![]() +OH
+OH
C.醋酸钠使酚酞溶液变红:CH3COONa+H2O=CH3COOH+NaOH
D.由Na和Cl形成离子键的过程:![]()
【答案】C
【解析】
A. 电解精炼铜,阳极电极反应式:Cu(粗铜)-2e-=Cu2+,阴极电极反应式:Cu2++2e=Cu,A正确;
B. 常温时,0.1mol/L氨水pH=11.1,c(OH-)=10-2.9mol/L,说明一水合氨为弱碱,部分电离,电离方程式:NH3·H2O![]() +OH,B正确;
+OH,B正确;
C. 醋酸钠溶液中,醋酸根离子发生水解,水解是可逆的,其水解方程式为:CH3COO-+H2O![]() CH3COOH+OH-,使溶液中的c(OH-)>c(H+),使酚酞溶液变红,C错误;
CH3COOH+OH-,使溶液中的c(OH-)>c(H+),使酚酞溶液变红,C错误;
D. NaCl是离子键形成的离子化合物,Na失去1个电子,Cl得到1个电子,则Na和Cl形成离子键的过程:![]() ,D正确;
,D正确;
故答案为:C。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
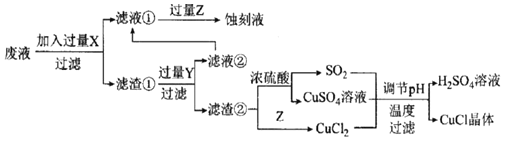
普通高中同步练习册系列答案【题目】砂质土壤分析中常用 Karl Fischer法是测定其中微量水含量,该方法是利用I2和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:_______________________。
步骤I:反应样品中的水
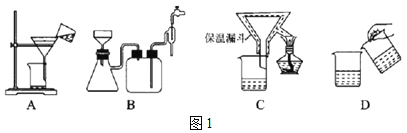
下图是某同学在实验室模拟Karl Fischer法的实验装置图:

(2)装置连接的顺序为a→____________(填接口字母顺序);M仪器的名称为________________,其在实验过程中的作用是:____________;
(3)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________;③关闭弹簧夹,打开分液漏斗活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2,⑤取下D装置,···
步骤④中继续通入N2的目的是________________________________
步骤 II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1 Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(4)Na2S2O3标准液应装在_____________(填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是__________________________;
(5)滴定实验重复四次得到数据如下:
实验 | ① | ② | ③ | ④ |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00 g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________%。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将____________(填“偏高”、“ 偏低”或“不变”)。
【题目】汽车尾气脱硝脱碳的主要原理为2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。在一定温度下,体积固定为2L的密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表所示:
时间/s | c(NO)/(mol·L-1) | c(CO)/(mol·L-1) |
0 | 9.50×10-3 | 9.00×10-3 |
1 | 4.50×10-3 | 4.00×10-3 |
2 | 2.50×10-3 | 2.00×10-3 |
3 | 1.50×10-3 | 1.00×10-3 |
4 | 1.50×10-3 | 1.00×10-3 |
下列说法正确的是
A.前2 s内的平均反应速率v(N2)=3.5×10-3mol·L-1·s-1
B.升高温度时,逆反应速率增大,正反应速率减小
C.容器内气体压强不再发生变化时,反应达到平衡状态
D.容器中气体的浓度c(NO):c(CO):c(N2):c(CO2)=2:2:1:2时,反应达到平衡状态