题目内容
在一定条件下,对于反应mA(g)+nB(g)  pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )
pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )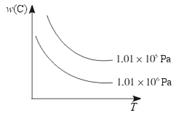
A.ΔH<0,m+n<p+q B.ΔH>0,m+n>p+q
C.ΔH>0,m+n<p+q D.ΔH<0,m+n>p+q
A
解析试题分析:根据图像可知,在压强相同时,随着温度的升高,C的含量逐渐降低,这说明升高温度平衡向逆反应方向移动,因此正反应是放热反应,即△H<0;当温度相同时,压强越大,C的含量越低,这说明增大压强,平衡向逆反应方向移动,因此正反应是体积增大的可逆反应,即m+n<p+q,答案选A。
考点:考查外界条件对平衡状态的影响、图像识别和分析
点评:该题是高考中的常见图像,属于中等难度的试题。该类试题需要注意的是在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。 二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。

 高效智能课时作业系列答案
高效智能课时作业系列答案下列图示与对应的叙述相符的是



甲 乙 丙 丁
A.图甲可以判断出反应A(g) + B(g) 2C(g) 的△H<0,T2>T1 2C(g) 的△H<0,T2>T1 |
B.图乙表示压强对可逆反应2A(g) + 2B(g) 3C(g) + D(s)的影响,乙的压强比甲的压强大 3C(g) + D(s)的影响,乙的压强比甲的压强大 |
| C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4 |
| D.图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化 |
下列反应体系中,不属于可逆反应的是
| A.Cl2溶解于水 |
| B.氨气溶解于水 |
| C.工业合成氨 |
| D.水电解生成H2和O2与H2在O2中燃烧生成H2O |
一密闭容器中充人1mol N2和3mol H2,在一定条件下发生反应N2+3H2 2NH3,下列有关说法正确的是( )
2NH3,下列有关说法正确的是( )
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当符合3u正(N2)=u正(H2)时,反应达到平衡状态 |
| C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2 |
| D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态 |
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是( )
2SO3(g)能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
在同温同压条件下,已知: C+CO2 2CO(正反应是吸热),正反应的反应速率为v1;N2+3H2
2CO(正反应是吸热),正反应的反应速率为v1;N2+3H2 2NH3(正反应是放热),正反应的反应速率为v2。对于上述反应,当温度同时升高时,v1和v2的变化情况正确的是
2NH3(正反应是放热),正反应的反应速率为v2。对于上述反应,当温度同时升高时,v1和v2的变化情况正确的是
| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |
被称为人体冷冻学之父的罗伯特·埃廷格(Robert Ettinger)在1962年写出《不朽的前景》(The Prospect Of Immortality)一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是
| A.温度越低,化学反应越慢 | B.低温下分子无法运动 |
| C.温度降低,化学反应停止 | D.化学反应前后质量守恒 |
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: N2(g)+O2(g)? 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
| A.消耗1 mol N2同时生成1 mol O2 | B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 | D.2v(N2)正=v(NO)逆 |
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____
 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是  CO2+ H2
CO2+ H2