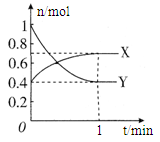
��Ŀ����
����β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ���£� N2(g)��O2(g)? 2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش�
2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش�
��1��ij�¶��£���2L���ܱ������г���N2��O2��1mol��5���Ӻ�O2�����ʵ���Ϊ0.5mol����N2�ķ�Ӧ����________��
��2���ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־________��
| A������1 mol N2ͬʱ����1 mol O2 | B����������ܶȲ��� |
| C���������ƽ����Է����������� | D��2v(N2)����v(NO)�� |

��4������º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ��������NO���������______��(������С�����䡱)
��5�����¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10��1mol/L��4.0��10��2mol/L��3.0��10��3mol/L����ʱ��Ӧ___________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��������____
��1��0.05 mol/(L��min)����2��A��D����3��A��C������4�����䣻��5�� ������Ӧ������С���ΪŨ����Qc<K
����

 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д���10�֣�800�桢2L�ܱ�������Ӧ2NO(g)��O2(g) 2NO2(g)��ϵ�У� n(NO)��
2NO2(g)��ϵ�У� n(NO)��
ʱ��ı仯�����
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����Ӧ���е�2 sʱc (NO)= ��
��2����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ�����ʦԣ�___________��
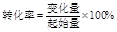 ��3�� ��Ӧ�ﵽƽ��״̬ʱNO��ת����= ������ʾ �� ��
��3�� ��Ӧ�ﵽƽ��״̬ʱNO��ת����= ������ʾ �� ����4���ж�һ���淴Ӧ�Ƿ�ﵽƽ��״̬�������кܶ࣬ijͬѧ��Ը÷�Ӧ���һ�����룺�ⶨ������������ܶȣ����ܶȲ��ٸı�ʱ�����жϳ��÷�Ӧ�Ѿ��ﵽƽ��״̬������Ϊ���������Ƿ���ȷ�� ����ǡ�����˵��������� ��
��֪��N2O4(g)  2NO2(g) ��H="+57.20kJ" �� mol-1
2NO2(g) ��H="+57.20kJ" �� mol-1
��100��ʱ����0.100molN2O4�������1L���ݳ�յ��ܱ������У�ÿ��һ��ʱ��Ը������ڵ�����Ũ�Ƚ��з����õ��±����ݣ�
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| c(N2O4) /mol����L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2) /mol��L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
��1�� �÷�Ӧ��ƽ�ⳣ������ʽΪ ______���ӱ������ݷ�����
c1 c2 (�>�� ����<�� ��="��" ����
��2������������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����
A��������ѹǿ���ٷ����仯
B��NO2������������ٷ����仯
C������������ԭ���������ٷ����仯
D����ͬʱ��������n mol N2O4��ͬʱ����2n mol NO2
E����Ӧ��ϵ��NO2��N2O4�������Ϊ1:2
��3������ʼʱ����NO2����0.200mol����ﵽƽ��ʱNO2�����ת����Ϊa��������������ʱ�����д�ʩ�����NO2ת���ʵ��� (����ĸ����
A�������¶ȡ���
B����СNO2��Ũ�ȡ���
C�������¶�
D������NO2��Ũ�ȡ���
E���ٳ���һ������He
(14��)������һЩ���ʵ��۷е�����(��ѹ)��
| | �� | �� | Na2CO3 | ���ʯ | ʯī |
| �۵�(��) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| �е�(��) | 774 | 882.9 | 1850(�ֽ����CO2) | --- | 4250 |
4Na(g)+3CO2(g)
 2Na2CO3(1)+C(s�����ʯ)����H��-1080��9kJ��mol
2Na2CO3(1)+C(s�����ʯ)����H��-1080��9kJ��mol(1)������Ӧ��ƽ�ⳣ������ʽΪ ����4v��(Na)��3v��(CO2)����Ӧ�Ƿ�ﵽƽ�� (ѡ��ǡ���)��
(2)����Ӧ��10L�ܱ���������ѹ�½��У��¶���890�����ߵ�1860�棬����Ӧʱ��Ϊ10min�������Ƶ����ʵ���������0��2mol����10min��CO2��ƽ����Ӧ����Ϊ ��
(3)��ѹ�������ڽ��ʯ���Ʊ������� ��
(4)��CO2(g)+4Na(g)��2Na2O(s)+C(s�����ʯ) ��H��-357��5kJ��mol����Na2O������C(���ʯ)��Ӧ�õ�Na(g)��Һ̬Na2CO3(1)���Ȼ�ѧ����ʽ�� ��
(5)��ͼ����K��Mʱ��ʯī�� �����缫��ӦʽΪ ����K��Nһ��ʱ������0.3mol����ת�ƣ�����y��x�仯��ͼ��x������n(H2O)������y������n[Al(OH)3]����Ӧ�������������й����ݡ�
��10�֣���һ�������£���������������������·�Ӧ��
2SO2(g)��O2(g) 2SO3(g)����H��0
2SO3(g)����H��0
��1��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK��__________��
��2�������¶ȣ��÷�ӦKֵ______����������ת����______����ѧ��Ӧ����______��(���Ͼ��������С�����䡱)
��3��600 ��ʱ����һ�ܱ������У������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ��ʾ����Ӧ����ƽ��״̬��ʱ����________��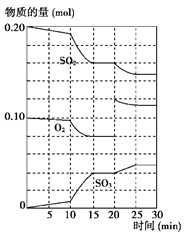
��4������ͼ�жϣ���Ӧ������20 minʱ�����߷����仯��ԭ����________________ _(�����ֱ���)��10 min��15 min�����߱仯��ԭ�������________(��д���)��
| A�����˴������� | B����С������� | C�������¶� | D������SO3�����ʵ��� |
 pC(g)+qD(g)��C���ʵ�����������w��C�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��
pC(g)+qD(g)��C���ʵ�����������w��C�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��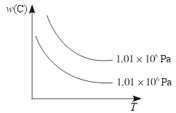
 HSO3��+OH��ˮ��ƽ�����ʵ�� ����ѡ����ĸ����
HSO3��+OH��ˮ��ƽ�����ʵ�� ����ѡ����ĸ���� C(g)��3D(s)�����ܱ��������ݻ����¶ȶ���ͬ�������£��ֱ����������;������ƽ�⣺��. A��B����ʼ���ʵ�����Ϊ2 mol����.C��D����ʼ���ʵ����ֱ�Ϊ2 mol��6 mol������˵������ȷ���� ����ѡ����ĸ����
C(g)��3D(s)�����ܱ��������ݻ����¶ȶ���ͬ�������£��ֱ����������;������ƽ�⣺��. A��B����ʼ���ʵ�����Ϊ2 mol����.C��D����ʼ���ʵ����ֱ�Ϊ2 mol��6 mol������˵������ȷ���� ����ѡ����ĸ���� CO2(g) + H2(g) ��H �� 0�����д�ʩ����߷�Ӧ���ʵ��� ��������ѡ��
CO2(g) + H2(g) ��H �� 0�����д�ʩ����߷�Ӧ���ʵ��� ��������ѡ�� N2O4(g) (��ɫ)����ͼ��ʾ��
N2O4(g) (��ɫ)����ͼ��ʾ��