题目内容
一密闭容器中充人1mol N2和3mol H2,在一定条件下发生反应N2+3H2 2NH3,下列有关说法正确的是( )
2NH3,下列有关说法正确的是( )
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当符合3u正(N2)=u正(H2)时,反应达到平衡状态 |
| C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2 |
| D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态 |
C
解析试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项A不正确;选项B中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此B中的关系始终是成立,不正确;C中反应速率的方向相反,且满足反应速率之比是相应的化学计量数之比,正确;平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,D不正确,答案选C。
考点:考查可逆反应平衡状态的判断
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点、特征,然后结合具体的可逆反应灵活运用即可。

 高中必刷题系列答案
高中必刷题系列答案甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l) HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq) △H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
| A.温度升高,该反应的平衡常数减小 |
| B.0?10min,HCOOCH3的平均反应速率 u="0." 003mol·L-1 ? min-1 |
| C.HCOOCH3平均反应速率先是增大,后减小,最后保持不变 |
| D.80min时,反应刚达平衡,反应物转化率保持不变 |
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使放出H2速率加快的是
①升高温度
②改用100mL 1mol/L硫酸
③多用300mL 1mol/L盐酸;
④用等量锌粉代替锌粒
⑤改用100mL 6mol/L硝酸
⑥滴入几滴硫酸铜溶液
⑦用粗锌代替纯锌使用
| A.①③④⑤⑦ | B.①②④⑥⑦ | C.②③④⑤⑥ | D.①②③⑥⑦ |
密闭容器中,反应xA(g)+yB(g)  zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是 ( )
zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是 ( )
| A.x+y>z | B.平衡向正方向移动 |
| C.B的转化率降低 | D.C的体积分数下降 |
一定温度下,可逆反应H2(g)+I2(g) 2HI(g)达到化学平衡状态的标志是( )
2HI(g)达到化学平衡状态的标志是( )
| A.混合气体的压强不再变化 | B.混合气体的颜色不再变化 |
| C.反应速率v(H2)="0.5v" (HI) | D.c (H2):c(I2):c(HI)=1:1:2 |
 2B(g)+C(g);②A(g)
2B(g)+C(g);②A(g)  pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )
pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )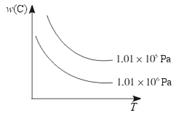
 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )  CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。