题目内容
18.在溶液中能大量共存的一组离子或分子是( )| A. | NH4+、H+、NO3-、HCO3- | B. | K+、Al3+、SO42-、NH3•H2O | ||
| C. | Na+、K+、SO32-、Cl2 | D. | Na+、Mg2-、SO42-、H+ |
分析 A.氢离子与碳酸氢根离子反应生成二氧化碳气体;
B.铝离子与一水合氨反应生成氢氧化铝沉淀;
C.氯气具有强氧化性,能够氧化亚硫酸根离子;
D.四种离子之间不发生反应,能够大量共存.
解答 解:A.H+、HCO3-之间反映生成二氧化碳气体和水,在溶液中不能大量共存,故A错误;
B.Al3+、NH3•H2O之间发生反应生成氢氧化铝沉淀,在溶液中不能大量共存,故B错误;
C.SO32-、Cl2之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.Na+、Mg2-、SO42-、H+之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
6.在某一体积可变的恒温密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )
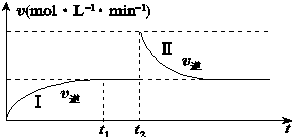

| A. | 0~t2时,v正始终大于v逆 | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ | |
| D. | t2时刻改变的条件可以是向密闭容器中加C |
3. 在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )
在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )
 在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )
在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )| A. | 脱硫反应△H<0 | |
| B. | 及时从体系中除去水,平衡常熟增大 | |
| C. | 相同条件下,催化剂活性越大,SO2的平衡转化率越高 | |
| D. | $\frac{n(N{H}_{3})}{n(S{O}_{2})}$:a<b<c |
10.根据下列操作及现象,所得结论正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 向2mL1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3 | Mg(OH)2转化为Fe(OH)3 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
7.下列物质中能使品红溶液褪色,加热后溶液又恢复原来颜色的是( )
| A. | Cl2 | B. | NO2 | C. | SO2 | D. | H2O2 |
8.下列关于有机物的说法不正确是( )
| A. | 油脂是热值最高的营养物质 | |
| B. | 苯和乙醇都能发生氧化反应 | |
| C. | 聚乙烯能使酸性高锰酸钾溶液褪色 | |
| D. | 用Na2CO3溶液可以区分CH3COOH和CH3COOCH2CH3 |
 .
.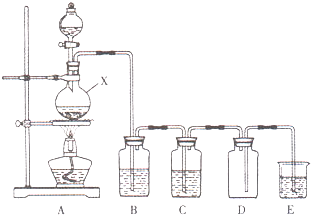 实验室中常用二氧化锰与浓盐酸共热制取氯气.某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置.
实验室中常用二氧化锰与浓盐酸共热制取氯气.某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置.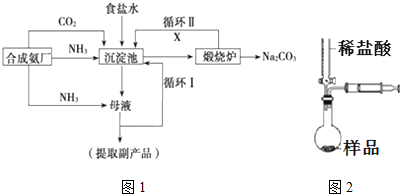
 ,沉淀池中发生的化学反应方程式为:CO2+NH3+NaCl+H2O═NaHCO3↓+NH4Cl.
,沉淀池中发生的化学反应方程式为:CO2+NH3+NaCl+H2O═NaHCO3↓+NH4Cl.