题目内容
9.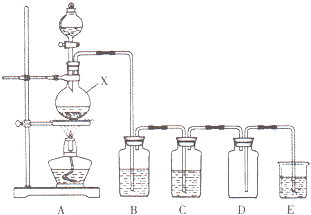 实验室中常用二氧化锰与浓盐酸共热制取氯气.某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置.
实验室中常用二氧化锰与浓盐酸共热制取氯气.某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置.请按要求回答下列问题:
(1)仪器X的名称为圆底烧瓶,其中发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)欲除去Cl2中的HCl,装置B应选用的试剂为a.
a.饱和食盐水b.饱和氢氧化钠溶液c.饱和亚硫酸钠溶液
(3)进入装置B中的Cl2中含有的杂质,除HCl外还有水蒸气,欲除去该杂质,装置C中盛放的试剂名称为浓硫酸.
(4)装置D中的一处明显的错误为进气导管靠近瓶塞且出气导管靠近瓶底,应倒过来.
(5)装置E中的试剂为饱和氢氧化钠溶液,其作用为吸收多余的氯气尾气,防止尾气泄露,污染环境.
(6)加热150mL 12mol/L HCl溶液和3.48g MnO2粉末的混合物,若反应充分发生,则理论上可产生的Cl2在标准状况下的体积为896 mL.
分析 (1)熟悉仪器图象,说出其名称;二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)因氯气难溶于饱和食盐水,氯化氢极易溶于水,则除去Cl2中的HCl可通过饱和食盐水;
(3)水蒸气受热挥发,所以氯气中还含有水蒸气,浓硫酸具有吸水性,可以干燥氯气;
(4)氯气密度大于空气密度,应用向上排气法收集;
(5)氯气有毒,不能直接排放,应进行尾气处理,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,可用氢氧化钠吸收;
(6)依据反应方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O 计算产生氯气的物质的量,进而计算标况下气体体积.
解答 解:(1)图中X为圆底烧瓶;二氧化锰与浓盐酸反应方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:圆底烧瓶;MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)因氯气难溶于饱和食盐水,则可先将气体通过饱和食盐水,
故答案为:a;
(3)水蒸气受热挥发,所以氯气中还含有水蒸气,浓硫酸具有吸水性,可以吸收氯气中的水蒸气;
故答案为:水蒸汽,浓硫酸;
(4)氯气密度大于空气密度,应用向上排气法收集,应长进短出;
故答案为:进气导管靠近瓶塞且出气导管靠近瓶底,应倒过来;
(5)氯气有毒,直接排放引起空气污染,应用氢氧化钠溶液吸收过来的氯气;
故答案为:饱和氢氧化钠溶液,吸收多余的氯气尾气,防止尾气泄露,污染环境;
(6)二氧化锰的物质的量为$\frac{3.48g}{87g/mol}$=0.04mol;
氯化氢的物质的量为:0.150L×12mol/L=1.8mol;
根据化学反应方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知氯化氢过量,
则生成氯气的物质量依据二氧化锰计算,
MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
1 1
0.04mol 0.04mol
标况下氯气的体积为:0.04mol×22.4L/mol=0.896L=896ml;
故答案为:896.
点评 本题考查了氯气的制备和性质的检验,熟悉反应原理及氯气的化学性质是解题关键,注意只有浓盐酸才能与二氧化锰反应.

| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. |  和 和 互称同分异构体 互称同分异构体 |
| A. | 在相同温度下,Na2CO3比NaHCO3的溶解度小 | |
| B. | 可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 可用加热的方法除去Na2CO3中混有的NaHCO3杂质 | |
| D. | Na2CO3和NaHCO3固体分别与盐酸反应产生等量的CO2时,后者消耗的H+多 |
| A. | 铁红常用作红色油漆和涂料 | |
| B. | 明矾可用作净水剂 | |
| C. | 氯气可用于制造漂白粉 | |
| D. | 氧化钠常用作呼吸面具中氧气的来源 |
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=a+2b-2ckJ•mol-1.
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示.
①a点所代表的状态不是(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是b、c点都未达到平衡状态,c点温度高,反应速率快,二氧化碳的转化率较大.

(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2?CO+H2O,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到数据图2、3:
①由图2得,最佳空间流率为3600h-1;
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如如表数据,试说明不选择单组份ZnO原因是使用单组分ZnO时反应速率虽然快,但是由图3可知,二氧化碳转化率、甲醇的产率都过低,实际生产中没有意义,故不采用.
| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
①该进行的反应的△S<0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=$\frac{p({C}_{2}{H}_{4})•{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})•{p}^{6}({H}_{2})}$.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强;提高氢气和二氧化碳物质的量的比值(列举2项).
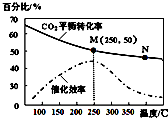
| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 平衡常数:KM>KN | |
| C. | 当温度高于250℃,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、Al3+、SO42-、NH3•H2O | ||
| C. | Na+、K+、SO32-、Cl2 | D. | Na+、Mg2-、SO42-、H+ |
| A. | 纤维素和淀粉互称同分异构体 | B. | 甲烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. |  和 和 互称同分异构体 互称同分异构体 |