题目内容
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q 184.8kJ(填“>”、“<”或“=”)。一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
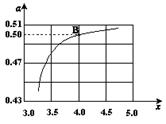
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)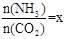 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
(3)图中的B点处,NH3的平衡转化率为 。
(4)已知: 3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→ ――③
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q 184.8kJ(填“>”、“<”或“=”)。一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g)
 CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
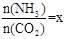 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。(3)图中的B点处,NH3的平衡转化率为 。

(4)已知: 3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→ ――③
(1)< a (共4分,各2分)
(2)c(NH3)增大,平衡正向移动,所以CO2的转化率增大 (2分)
(3)25% (2分)
(4)12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl (2分)
(2)c(NH3)增大,平衡正向移动,所以CO2的转化率增大 (2分)
(3)25% (2分)
(4)12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl (2分)
试题分析:(1)根据题给信息知,合成氨反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,合成氨的反应是可逆反应不能进行彻底,该温度下合成塔中放入2mol N2和6mol H2,生成的氨气小于2mol,故达平衡后放出的热量小于184.4 kJ;一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 a.3v逆(N2)=v正(H2),符合v正= v逆,正确;b.2v正(H2)= v正(NH3)两个反应速率均为正反应速率,错误;c.混合气体密度不随反应的进行而变化,不能作为平衡状态的依据,错误;d.平衡时c(N2):c(H2):c(NH3)不一定为1:3:2,错误;选a;(2)根据题给图像及信息分析,CO2平衡转化率(α)随着x增大而增大的原因是c(NH3)增大,平衡正向移动,所以CO2的转化率增大;(3)B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为50%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.50mol,依据化学方程式2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)知,参加反应的氨气为1.00mol,NH3的平衡转化率为25%;(4)根据题给信息及氧化还原方程式的书写原则写出该反应的化学方程式为:12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl 。
CO(NH2)2(l)+H2O(l)知,参加反应的氨气为1.00mol,NH3的平衡转化率为25%;(4)根据题给信息及氧化还原方程式的书写原则写出该反应的化学方程式为:12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl 。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C
