题目内容
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+H2O(未配平)中,如果有6 mol Cl2完全反应,则被氧化的OCN-的物质的量是 ( )。
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |
C
OCN-中C显+4价,N显-3价,反应中只有N和Cl的化合价改变,根据OCN-
 N2、Cl2
N2、Cl2 2Cl-,由得失电子守恒:2n(Cl2)=3n(OCN-),可知6 mol Cl2完全反应,有4 mol OCN-被氧化,C对。
2Cl-,由得失电子守恒:2n(Cl2)=3n(OCN-),可知6 mol Cl2完全反应,有4 mol OCN-被氧化,C对。

 N2、Cl2
N2、Cl2 2Cl-,由得失电子守恒:2n(Cl2)=3n(OCN-),可知6 mol Cl2完全反应,有4 mol OCN-被氧化,C对。
2Cl-,由得失电子守恒:2n(Cl2)=3n(OCN-),可知6 mol Cl2完全反应,有4 mol OCN-被氧化,C对。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



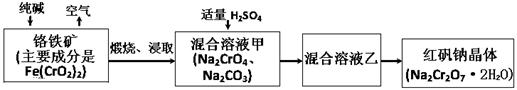
 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。 (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。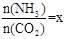 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。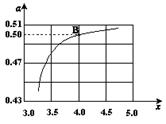

 。 反应①的化学方程式为 ;
。 反应①的化学方程式为 ;