题目内容
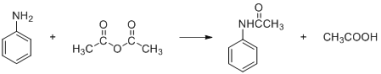
【题目】酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐加热来制取,该反应放热:
密度(g/mL) | 相对分子质量 | 颜色、状态 | 溶解性 | |
苯胺 | 1.04 | 93 | 无色油状液体 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 无色透明液体 | 遇水缓慢反应生成乙酸 |
乙酰苯胺 | 135 | 无色片状晶体, 熔点 114℃ | 不溶于冷水,可溶于热 水、乙醇、乙醚 |
实验步骤
①取5.00 mL苯胺,倒入100 mL锥形瓶中,加入20 mL水,在旋摇下分批加入6.00 mL 乙酸酐,搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150 mL烧杯中,加入适量水配制成 80 ℃的饱和溶液,再加入过量20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5 min,_______,冷却结晶,抽滤、洗涤、晾干得乙酰苯胺纯品6.2 g。
请回答:
(1)反应温度过高会导致苯胺挥发,下列操作可控制反应温度,防止反应温度升高过快的是______。
A 加20 mL水 B 旋摇下分批加入6.0 mL乙酸酐
C 玻璃棒将块状物研碎 D 充分搅拌
(2)在步骤②中对粗产品进行洗涤需要用到以下操作:
a 加入洗涤剂至浸没固体;b 洗涤剂缓慢通过;c 关小水龙头;d 开大水龙头; e 重复 2~3 次。
请对以上操作做出正确的排序__________。
(3)步骤③加入过量 20%的水的目的是________,横线处的操作步骤是_________。
(4)下列说法不正确的是______。
A 活性炭吸附有色物质,可以提高产率
B 冷却时,室温冷却比冰水浴冷却更易得到大颗粒晶体便于抽滤
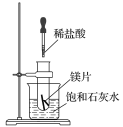
C 抽滤用如图装置,为防止倒吸,结束时可先关闭水龙头,后打开活塞a
D 产品可放在表面皿上用热水浴烘干,烘干后可通过测量产品熔点判断产品纯度
(5)该实验的产率是___________。
【答案】AB cabde 加入过量 20%的水的目的是防止加热煮沸时,溶剂减少使产品析出导致产率降低 趁热过滤 AC 82.1%
【解析】
苯胺和乙酸酐反应得到乙酰苯胺,乙酰苯胺不溶于冷水,因此得到的产物为固体,抽滤得到粗品,转移到烧杯中,加热,乙酰苯胺溶于热水,加入活性炭漂白,在趁热过滤,冷却结晶得到纯品。
(1)反应温度过高会导致苯胺挥发,需要控制反应温度和反应速率;A.加20mL水,可以使溶液稀释,降低反应速率,还可以使溶液质量增大,从而降低了温度,A正确;
B.旋摇下分批加入6.0mL乙酸酐,使反应物浓度较小,反应速率较慢,从而降低了反应温度,B正确;
C.玻璃棒将块状物研碎,目的是防止原料被产物包裹,使之充分反应,不利于控制温度,C错误;
D.反应快结束时的充分搅拌,使反应更完全,无法降低反应速率,可能会导致反应速率加快,温度升高,D错误;
答案选AB;
(2)粗产品的洗涤时,开始不能开大水龙头,因为水龙头开得越大,抽滤越快,使得洗涤液不能浸没固体,因此开始应该关小水龙头,在加入洗涤液浸没固体,洗涤剂会缓慢通过,再开得水龙头,加快抽滤速度,再重复几次,因此正确排序为cabde;
(3)粗产品配制80℃的饱和溶液中会损失部分溶剂,可能使得粗产品不能完全溶解,因此加入过量20%的水的目的是防止加热煮沸时,溶剂减少使产品析出导致产率降低;根据乙酰苯胺的溶解度,不溶于冷水,而溶于热水,因此过滤热的饱和溶液可以除去不溶于水的杂质,在冷却结晶,因此横线处的操作为趁热过滤;
(4)A.加活性炭吸附有色物质,无法提高产率,A错误;
B.自然冷却,可使晶粒生长,得到较大颗粒的晶体,冰水浴冷却比室温冷却得到的晶体颗粒小,颗粒大有利于过滤,B正确;
C.为防止倒吸,应先打开活塞a,再关闭抽气泵,C错误;
D.乙酰苯胺的熔点为114℃,可以用热水浴加热,水的温度不超过熔点;纯净物具有固定的熔点,可以通过测定熔点判断产品的纯度,D正确;
答案选AC;
(5)5mL苯胺的物质的量=![]() ,6mL乙酸酐的物质的量=
,6mL乙酸酐的物质的量=![]() ,苯胺少量,按苯胺计算,理论得到乙酰苯胺的质量=0.05591mol×135g·mol-1≈7.548g,则产率为6.2g÷7.548g×100%≈82.1%。
,苯胺少量,按苯胺计算,理论得到乙酰苯胺的质量=0.05591mol×135g·mol-1≈7.548g,则产率为6.2g÷7.548g×100%≈82.1%。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如图所示。
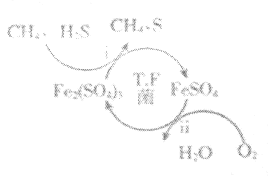
(1)过程i中H2S发生了___(填“氧化”或“还原”)反应。
(2)过程ii的离子方程式是___。
(3)已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
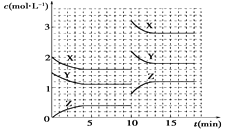
pH | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
Fe2+氧化速率/(g·L-1·h-1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
请结合以上信息,判断工业脱硫应选择的最佳pH范围,并说明原因:___。
II.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
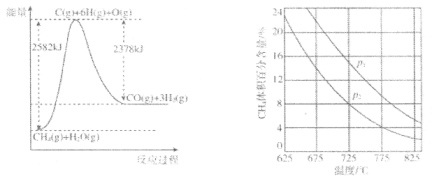
(4)①该过程的热化学方程式是___。
②比较压强p1和p2的大小关系:p1___p2(选填“>”“<”或“=”)。
III.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
IV.H2提纯:将CO2和H2分离得到H2的过程示意图如图。
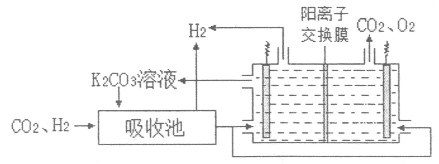
(5)①吸收池中发生反应的离子方程式是___。
②结合电极反应式,简述K2CO3溶液的再生原理:___。