题目内容
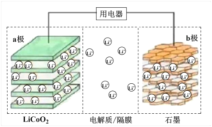
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的结构如图所示,电池反应式为 LixC6 + Li1-xCoO2![]() C6 + LiCoO2(x<1)。下列说法正确的是
C6 + LiCoO2(x<1)。下列说法正确的是
A.放电时,a极为负极
B.充电时,Li1-xCoO2/LiCoO2电极发生Li+脱嵌,放电时发生Li+嵌入
C.放电时,若转移0.02mol电子,石墨电极将减重0.21g
D.放电时,Li+在电解质中由a极向b极迁移
【答案】B
【解析】
根据电池反应式可知,负极反应式为LixC6-xe-=C6+xLi+,正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,即b为负极,a为正极,充电时,阴极、阳极反应式与负极、正极反应式正好相反。
A.根据分析可知,a为原电池的正极,A错误;
B.由电极方程式可知,充电时,Li1-xCoO2/LiCoO2电极发生Li+脱嵌,失去电子;放电时发生Li+嵌入,得到电子,B正确;
C.放电时,石墨电极发生得电子的反应,若转移0.02mol电子,则石墨电极将减重0.02![]() 7=0.14g,C错误;
7=0.14g,C错误;
D.放电时,Li+负极向正极移动,即由b极向a极移动,D错误;
故选C。

【题目】酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐加热来制取,该反应放热:
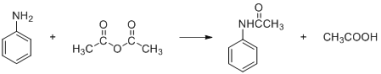
密度(g/mL) | 相对分子质量 | 颜色、状态 | 溶解性 | |
苯胺 | 1.04 | 93 | 无色油状液体 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 无色透明液体 | 遇水缓慢反应生成乙酸 |
乙酰苯胺 | 135 | 无色片状晶体, 熔点 114℃ | 不溶于冷水,可溶于热 水、乙醇、乙醚 |
实验步骤
①取5.00 mL苯胺,倒入100 mL锥形瓶中,加入20 mL水,在旋摇下分批加入6.00 mL 乙酸酐,搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150 mL烧杯中,加入适量水配制成 80 ℃的饱和溶液,再加入过量20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5 min,_______,冷却结晶,抽滤、洗涤、晾干得乙酰苯胺纯品6.2 g。
请回答:
(1)反应温度过高会导致苯胺挥发,下列操作可控制反应温度,防止反应温度升高过快的是______。
A 加20 mL水 B 旋摇下分批加入6.0 mL乙酸酐
C 玻璃棒将块状物研碎 D 充分搅拌
(2)在步骤②中对粗产品进行洗涤需要用到以下操作:
a 加入洗涤剂至浸没固体;b 洗涤剂缓慢通过;c 关小水龙头;d 开大水龙头; e 重复 2~3 次。
请对以上操作做出正确的排序__________。
(3)步骤③加入过量 20%的水的目的是________,横线处的操作步骤是_________。
(4)下列说法不正确的是______。
A 活性炭吸附有色物质,可以提高产率
B 冷却时,室温冷却比冰水浴冷却更易得到大颗粒晶体便于抽滤
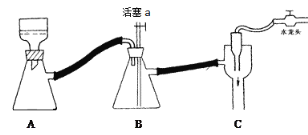
C 抽滤用如图装置,为防止倒吸,结束时可先关闭水龙头,后打开活塞a
D 产品可放在表面皿上用热水浴烘干,烘干后可通过测量产品熔点判断产品纯度
(5)该实验的产率是___________。
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。下表为元素有关信息:
元素 | 信息 |
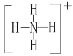
B | 其单质在常温下为双原子分子,与A可形成分子X,且X的水溶液呈碱性 |
D | 其简单阳离子与X具有相同电子数,且是同周期中简单阳离子中半径最小的 |
E | 元素原子最外层比次外层少2个电子 |
C、F | 两种元素的原子最外层共有13个电子 |
回答下列问题:
(1)B的原子结构示意图为__,且在周期表中的位置为___。
(2)写出BA3气体验满的方法__。
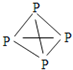
(3)F的单质在氧化还原反应中常做__剂,该单质与E的低价氧化物1:1通入水中,发生反应的离子方程式为__。
(4)C、D形成的化合物的化学式为__,此物质对应的水化物决定了在物质的分类中应属于__。