��Ŀ����
����Ŀ�������Dz��ֶ������еڶ�����������Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۣ�
Ԫ�ش��� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶��nm�� | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
��Ҫ���ϼ� | +1 | +2 | +1 | +3 | +5����3 | +7����1 | +5����3 | ��2 |
�ش��������⣺
��1������Ԫ�����ڱ��е�λ���������ڡ��壩��
��2��8��Ԫ�ص�����������ˮ�����У�������ǿ�������ѧʽ����
��3��Ԫ�آݡ��ߡ���ֱ��γɵļ���̬�⻯���У��ߵĵ���ʽΪ �� �ȶ�����ǿ���⻯��ĽṹʽΪ��
��4��д���١��ܵ�����������Ӧ��ˮ����֮�䷢����Ӧ�����ӷ���ʽ��
��5���õ���ʽ��ʾԪ�آ�����γɻ�����Ĺ��� ��
���𰸡�
��1���ڶ�����VIA��
��2��HClO4
��3��![]() ��H��O��H
��H��O��H
��4��Al��OH��3+OH���TAlO2��+2H2O
��5��![]()
���������⣺�ڶ���������Ԫ���У��٢۾���+1�ۣ�����IA�壬ԭ�Ӱ뾶�٣��ۣ����ΪNa����ΪLi���ݢ߾���+5����3�ۣ�ԭ�Ӱ뾶�ݣ��ߣ����ΪPԪ�ء���ΪNԪ�أ�����+2�ۣ����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪMg������+3�ۣ����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪAl������+7����1�ۣ����ΪCl�����Щ�2�ۣ�����VIA�壬ԭ�Ӱ뾶С���ȣ��ʢ�ΪOԪ��.
��1.����ΪOԪ�أ���Ԫ�����ڱ��е�λ���ǣ��ڶ�����VIA�壬�ʴ�Ϊ���ڶ�����VIA�壻
��2.��8��Ԫ�ص�����������ˮ�����У�������ǿ����HClO4 �� �ʴ�Ϊ��HClO4��
��3.����ΪNԪ�أ���Ӧ���⻯��Ϊ����������ʽΪ 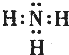 ���ǽ�����O��N��P���⻯�����ȶ���Ϊˮ���ṹʽΪH��O��H���ʴ�Ϊ��
���ǽ�����O��N��P���⻯�����ȶ���Ϊˮ���ṹʽΪH��O��H���ʴ�Ϊ�� 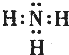 ��H��O��H��
��H��O��H��
��4.���١��ܵ�����������Ӧ��ˮ����ֱ�Ϊ�������ơ��������������������������ԣ����������Ʒ�Ӧ�����ӷ���ʽΪAl��OH��3+OH���TAlO2��+2H2O���ʴ�Ϊ��Al��OH��3+OH���TAlO2��+2H2O��
��5.����Ԫ�غ͢�Ԫ���γɻ�����ΪNaCl���õ���ʽ��ʾ�γɹ���Ϊ ![]() ��
��
�ʴ�Ϊ�� ![]() ��
��
�ڶ���������Ԫ���У��٢۾���+1�ۣ�����IA�壬ԭ�Ӱ뾶�٣��ۣ����ΪNa����ΪLi���ݢ߾���+5����3�ۣ�ԭ�Ӱ뾶�ݣ��ߣ����ΪPԪ�ء���ΪNԪ�أ�����+2�ۣ����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪMg������+3�ۣ����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪAl������+7����1�ۣ����ΪCl�����Щ�2�ۣ�����VIA�壬ԭ�Ӱ뾶С���ȣ��ʢ�ΪOԪ�أ��Դ˽����⣮

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�