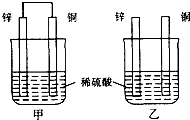
题目内容
【题目】在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)x值等于________________;
(2)A的转化率为________;
(3)如果增大反应体系的压强,则平衡体系中C的质量分数________(增大、减小、不变)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4 /3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入B物质___ mol。
【答案】 2 60% 不变 ![]()
【解析】(1)平衡时C的浓度为0.4 mol·L-1,则n(C)=0.4 mol·L-1×2L=0.8mol,因为物质的量之比等于化学计量数之比,所以0.8mol:0.8mol=x:2,解得x=2。
(2)平衡时n(D)=0.8mol,由方程式可知参加反应的n(A)= ![]() n(D)=
n(D)= ![]() ×0.8mol=1.2mol,故A的转化率为:1.2mol÷2mol×100%=60%。
×0.8mol=1.2mol,故A的转化率为:1.2mol÷2mol×100%=60%。
(3)因为反应前后气体的物质的量不变,所以增大压强平衡不移动,故平衡体系中C的质量分数不变。
(4)该反应前后气体的物质的量不变,恒温恒容下,要使后来的平衡与原平衡是等效平衡,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,那么把生成物全部转化成反应物, ![]() molC和
molC和![]() molD全部转化可以得到2molA和
molD全部转化可以得到2molA和![]() molB,但原来是2molA和2molB,所以还需要再加入
molB,但原来是2molA和2molB,所以还需要再加入![]() molB。
molB。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】环境问题成为人类共同关注的问题,欧洲很多国家提出了燃油车2036年停产时间表。也有专家提出燃油车远未到穷途末路,只要解决燃油汽车排放的尾气中的SO2、CO和NO污染问题就还有很长的生命,请回答以下问题:
(1)在汽车尾气管中加装催化剂成为汽车尾气治理的常用方法,已知:
①N2(g)+ O2(g)=2NO(g) △H=180.5 kJ/mol
②2CO(g)+ O2(g)=2CO2(g) △H=-566kJ/mol
写出NO(g)与CO(g)在催化剂作用下转化成N2(g)和CO2(g)的热化学方程式________________________。
(2)汽车尾气中的少量NO2也可以和CO反应生成N2(g)和CO2(g),热化学方程式为:
2NO2(g)+4CO(g)= N2(g)+4CO2(g) ,ΔH=QkJ·mol-1,试判断Q_______0(填“>”或“<”或“=”)。理由是_________________________________________
(3)除了汽车尾气产生的污染外,工业尾气及北方冬季燃煤产生SO2的污染治理也非常重要,可模仿工业上用2SO2(g )+O2(g) ![]() 2SO3(g)以制取硫酸,现在一容积固定为10L的密闭容器中进行该反应,现测得如下数据:
2SO3(g)以制取硫酸,现在一容积固定为10L的密闭容器中进行该反应,现测得如下数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
SO2 | O2 | SO2 | |||
1 | 550 | 4 | 2 | 0.4 | 9 |
2 | 650 | 2 | 1 | 0.4 | 3 |
3 | 650 | a | b | c | t |