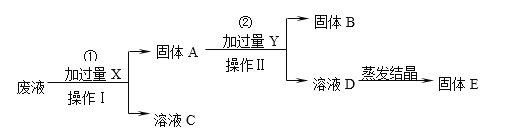
题目内容
【题目】(1)已知拆开1mol H—H键、1mol N—H键、1molN≡N键需要的能量分别是436 kJ、391 kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:
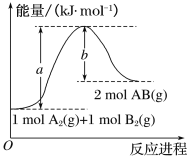
①该反应的ΔH___0(填“大于”“小于”或“等于”);
②反应物的总键能为__;
③写出该反应的热化学方程式____。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=___,联氨和N2O4可作为火箭推进剂的主要原因为____。
【答案】N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1 大于 akJ·mol-1 A2(g)+B2(g)=2AB(g) ΔH=+(a-b)kJ·mol-1 2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体、无污染
【解析】
(1)焓变=反应物的总键能-生成物的总键能;
(2)①根据图示,反应物总能量小于生成物总能量;
②反应物的总键能是断开1mol A2(g)和1mol B2(g)吸收的总能量;
③焓变=反应物的总键能-生成物的总键能;
(3)根据盖斯定律,反应热只与反应体系的始态、终态有关,与反应历程无关。
(1)N2与H2反应生成NH3的化学方程式为N2(g)+3H2(g)=2NH3(g),该反应的ΔH=反应物的键能总和-生成物的键能总和= 946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92kJ/mol;N2与H2反应生成NH3的热化学方程式为:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol。
(2)①1mol A2(g)和1mol B2(g)具有的总能量小于2molAB(g)具有的总能量,反应A2(g)+B2(g)=2AB(g)为吸热反应,ΔH大于0。
②根据图象,反应物的总键能为akJ/mol。
③根据图象,该反应的ΔH=+(a-b)kJ/mol,该反应的热化学方程式为:A2(g)+B2(g)=2AB(g) ΔH=+(a-b)kJ/mol。
(3)根据盖斯定律,将③×2-①-②×2得2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),则ΔH4=2ΔH3-ΔH1-2ΔH2。根据反应④知,联氨和N2O4作为火箭推进剂,反应放热量大、产生大量气体、无污染。