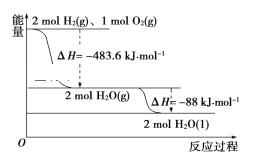
题目内容
【题目】(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: ___________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2![]() 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
(3)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,且c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g) ![]() CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
【答案】2 CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ·mol-1 -93 0.32a
【解析】
(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l) △H=-1452.8kJ/mol,故答案为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l) △H=-1452.8kJ/mol;
(2)N2(g)+3H2(g)2NH3(g) △H=945kJmol-1+436kJmol-1×3-391kJmol-1×6 =-93kJmol-1=a kJmol-1,因此a=-93;
(3)c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g) ![]() CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,则:
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,则:
CaSO4(s) + CO(g) ![]() CaO(s) + CO2(g) + SO2(g)
CaO(s) + CO2(g) + SO2(g)
开始时的浓度(mol/L) 1×10-4 0 0
改变的浓度(mol/L) 0.8×10-4 0.8×10-4 0.8×10-4
平衡时的浓度(mol/L) 0.2×10-4 0.8×10-4 0.8×10-4
平衡时的总压强为0.1a MPa×![]() =0.18 a MPa,CO(g)、CO2(g)、SO2(g)的平衡分压分别为
=0.18 a MPa,CO(g)、CO2(g)、SO2(g)的平衡分压分别为![]() ×0.18 a MPa=0.02 a MPa、
×0.18 a MPa=0.02 a MPa、![]() ×0.18 a MPa=0.08 a MPa、
×0.18 a MPa=0.08 a MPa、![]() ×0.18 a MPa=0.08 a MPa;
×0.18 a MPa=0.08 a MPa;
该反应的压强平衡常数Kp=![]() =0.32aMPa。
=0.32aMPa。