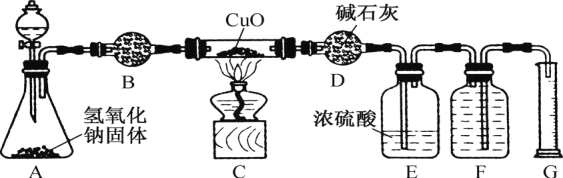
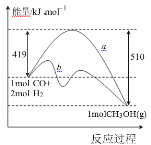
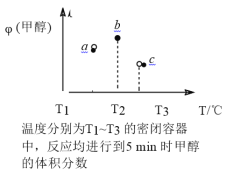
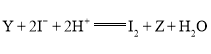题目内容
【题目】现有几组物质的熔点数据如表所示。
A组 | B组 | C组 | D组 |
金刚石:3550℃ |
|
|
|
硅晶体:1410℃ |
|
|
|
硼晶体:2300℃ |
|
|
|
二氧化硅:1723℃ |
|
|
|
请回答下列问题:
(1)A组属于______晶体,其熔化时克服的微粒间的作用力是______。
(2)B组晶体共同的物理性质是______(填序号)。
A.有金属光泽 B.有导电性 C.有导热性 D.有延展性
(3)C组中酸性最弱的是______,最不稳定的是______。
(4)D组晶体可能具有的性质是______(填序号)。
A.硬度小 B.水溶液能导电 C.固体能导电 D.熔融状态下能导电
【答案】原子 共价键 ABCD ![]()
![]() BD
BD
【解析】
A组物质的熔点都比较高;B组晶体都是金属晶体,具有金属通性;HF、HCl、HBr、HI的酸性逐渐增强;F、Cl、Br、I的非金属性逐渐减弱,据此判断分子的稳定性;D组晶体都是离子晶体,结合离子晶体的性质分析解答。
(1)A组物质的熔点都比较高,属于原子晶体,原子晶体的构成微粒为原子,微粒间作用力为共价键,熔化时需要克服共价键,故答案为:原子;共价键;
(2)B组晶体都是金属晶体,具有金属通性,所以具有导电性、导热性、延展性等物理性质,故选ABCD;
(3)HF、HCl、HBr、HI的酸性逐渐增强,酸性最弱的是HF;F、Cl、Br、I的非金属性逐渐减弱,HF、HCl、HBr、HI的稳定性逐渐减弱,最不稳定的是HI,故答案为:HF;HI;
(4)D组晶体都是离子晶体,离子晶体熔融态能导电,可溶性离子晶体在水溶液中能导电,固态时没有自由移动的离子,所以固体不导电,故答案为:BD。

练习册系列答案
相关题目