题目内容
【题目】常温下用惰性电极电解200 mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)。
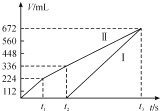
(1)曲线___(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)NaCl的物质的量浓度为___,CuSO4的物质的量浓度为___。
(3)t2时所得溶液的pH为___。
【答案】Ⅱ 0.1mol/L 0.1mol/L 1
【解析】
刚开始时阴极Cu2+得电子,无气体放出,Cu2+反应完溶液中的H+放电,Ⅰ是H2,阳极先是溶液中的Cl-放电,反应完后溶液中的OH-放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、2H2O—4e-=O2↑+4H+,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,计算时抓住电子守恒。
(1)电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl-﹣2e﹣=Cl2↑、2H2O—4e-=O2↑+4H+,阴极发生Cu2++2e﹣=Cu、2H++2e-﹣=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,故答案为:Ⅱ;
(2)由图可知,电解氯化钠溶液产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=![]() ×2=0.02mol,则NaCl的物质的量浓度c(NaCl)=
×2=0.02mol,则NaCl的物质的量浓度c(NaCl)=![]() =0.1mol/L,由t2时生成氧气为112mL,n(O2)=
=0.1mol/L,由t2时生成氧气为112mL,n(O2)=![]() =0.005mol,则阳极共转移电子为0.02mol+0.005mol×4=0.04mol,由得失电子数目守恒可知c(CuSO4)=
=0.005mol,则阳极共转移电子为0.02mol+0.005mol×4=0.04mol,由得失电子数目守恒可知c(CuSO4)=![]() =0.1mol/L,故答案为:0.1mol/L;0.1mol/L;
=0.1mol/L,故答案为:0.1mol/L;0.1mol/L;
(3)由t2时电极反应式2H2O—4e-=O2↑+4H+可知溶液中n(H+)=0.005mol×4=0.02mol,溶液的c(H+)=![]() =0.1mol/L,则溶液中pH=1,故答案为:1。
=0.1mol/L,则溶液中pH=1,故答案为:1。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】现有几组物质的熔点数据如表所示。
A组 | B组 | C组 | D组 |
金刚石:3550℃ |
|
|
|
硅晶体:1410℃ |
|
|
|
硼晶体:2300℃ |
|
|
|
二氧化硅:1723℃ |
|
|
|
请回答下列问题:
(1)A组属于______晶体,其熔化时克服的微粒间的作用力是______。
(2)B组晶体共同的物理性质是______(填序号)。
A.有金属光泽 B.有导电性 C.有导热性 D.有延展性
(3)C组中酸性最弱的是______,最不稳定的是______。
(4)D组晶体可能具有的性质是______(填序号)。
A.硬度小 B.水溶液能导电 C.固体能导电 D.熔融状态下能导电