题目内容
【题目】利用工业废气 CO2 或 CO 和 H2 在一定条件下可制备燃料甲醇。
Ⅰ.利用工业废气 CO 合成甲醇,其能量变化示意图如下:
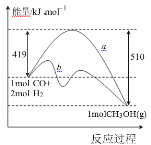
(1)图中曲线 a 到曲线 b 的措施是_______。该反应 ΔS________0(填“>”或“<”)
(2)一定条件下,在 2 L 密闭容器中充入 1 mol CO 和 2 mol H2,10 min 后达到平衡,放出热量 45.5kJ,则 10 min 内 H2 的转化率为_____;该温度下反应的平衡常数 K=_____;达到平衡后,再向容器中充入 CO、H2、CH3OH 各 1 mol,则此时 υ正_____υ逆 (填“>”“<”或“=”)
(3)下列措施可以提高甲醇产率的是_____。
a.压缩容器体积
b.将 CH3OH (g)从体系中分离
c.恒容条件下充入He,使体系总压强增大
d.恒压条件下再充入 10mol CO 和 20mol H2
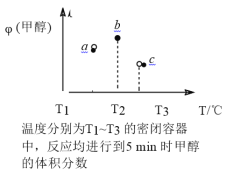
(4)现有容积均为 1L 的 a、b、c 三个密闭容器,向其中分别充入 1molCO 和 2molH2 的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b 中甲醇体积分数大于 a 中的原因是_______达到平衡时,a、b、c 中 CO 的转化率大小关系为_______。
Ⅱ.用工业废气中的 CO2制取甲醇和水蒸气
(5)一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应 I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
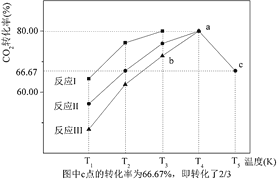
①催化剂效果最佳的反应是_____(填“反应 I”,“反应 II”,“反应 III”)。
②b 点υ正_____υ逆(填 “>”, “<”, “=”)。
③若此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因是_____。
④c点时该反应的平衡常数K=_____。
【答案】加入催化剂 < 50% 4 > ab b 处反应温度高,则反应速率快,反应相同时间生成的甲醇多,体积分数大 a>b>c 反应 I > 该反应为放热反应,温度升高,平衡逆向移动 ![]()
【解析】
(1)反应路径发生了变化,活化能下降,应为加入催化剂;反应发生后,气体物质的量减小,熵值减小,所以ΔS<0;
(2)2molH2完全反应释放的热量是91kJ,现在反应达平衡后只释放了45.5kJ的热量,所以H2消耗1mol,转化率为50%,化学方程式为CO(g)+2H2(g)![]() CH3OH(g),平衡时三种物质CO、H2、CH3OH的浓度分别为0.25mol/L、0.5mol/L、0.25mol/L,平衡常数K=
CH3OH(g),平衡时三种物质CO、H2、CH3OH的浓度分别为0.25mol/L、0.5mol/L、0.25mol/L,平衡常数K=![]() =
=![]() =4;三种物质都加入1mol后,Qc=
=4;三种物质都加入1mol后,Qc=![]() =
=![]() =1<K,反应正向移动,v正>v逆;
=1<K,反应正向移动,v正>v逆;
(3)a.压缩容器体积,平衡正向移动,甲醇产率增大,a符合题意;
b.将CH3OH(g)从体系中分离,平衡正向移动,甲醇产率增大,b符合题意;
c.恒容条件下充入He,各物质浓度不变,对平衡无影响,c不合题意;
d.恒压条件下再充入10molCO和20molH2,达到平衡时,各物质浓度不变,甲醇的产率不变,d不合题意;
答案为:ab;
(4)反应开始5min后,a中温度比b中低,反应速率比b中慢,生成甲醇的量少,体积分数小,所以,b中甲醇体积分数大于a中的原因是b处反应温度高,则反应速率快,反应相同时间生成的甲醇多,体积分数大;比较b、c两点甲醇的体积分数,可得出△H<0,温度升高平衡逆向移动,平衡时CO转化率依次减小,所以a>b>c。答案为:b处反应温度高,则反应速率快,反应相同时间生成的甲醇多,体积分数大;a>b>c;
(5)①在低温时,相同温度、相同时间内反应I转化率最高,所以催化剂效果最好的是反应I;
②b点尚未达到平衡状态,从催化剂效果更好的反应II和III可知,b点反应仍正向进行,所以υ正>υ逆;
③c点温度更高,比a提前达到平衡状态,所以a、c两点均是平衡点。从a、c点的比较可以看出,温度升高CO2的转化率减小,平衡逆向移动,所以正反应为放热反应,从而得出原因是:该反应为放热反应,温度升高,平衡逆向移动;
④利用三段式,可以建立以下关系:
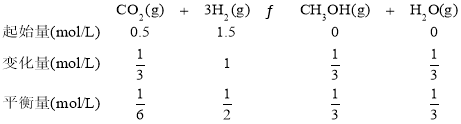
K=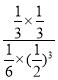 =
=![]() 。
。

【题目】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
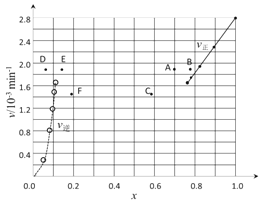
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=________min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2/span>)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)