题目内容
【题目】在一定条件下发生反应:2A(g)+2B(g) ![]() xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol·L-1·min-1,下列说法正确的是
A. A和B的转化率均是20% B. x = 2
C. 平衡时B的物质的量为1.2mol D. 平衡时气体压强比原来减小
【答案】C
【解析】根据反应速率之比等于化学计量数之比来确定化学计量数x,V(D)=0.2mol/(Lmin),V(C)= 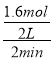 =0.4mol/(Lmin),则x=4;
=0.4mol/(Lmin),则x=4;
2A(g)+2B(g)![]() 4C(g)+2D(g),
4C(g)+2D(g),
开始 4 2 0 0
转化 0.80.81.60.8
平衡 3.21.21.60.8
A.A的的转化率=![]() ×100%=20%,B的转化率=
×100%=20%,B的转化率=![]() ×100%=40%,故A错误;B.由分析可知x=4,故B错误;C.由分析可知平衡时B的物质的量为1.2mol,故C正确;D.反应后气体总物质的量增加,恒温恒容条件下,容器内气体的压强增大,故D错误;故选C。
×100%=40%,故A错误;B.由分析可知x=4,故B错误;C.由分析可知平衡时B的物质的量为1.2mol,故C正确;D.反应后气体总物质的量增加,恒温恒容条件下,容器内气体的压强增大,故D错误;故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目