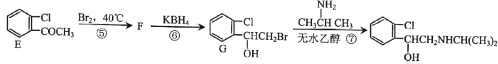
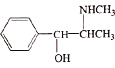
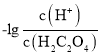题目内容
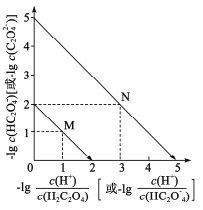
【题目】图1表示K、Cu、Si、H、C、N六种元素单质的熔点高低,其中c、d均是热和电的良导体,e常作为半导体材料。下列说法错误的是( )

A.d的硫酸盐溶液呈酸性
B.a元素与b元素可形成核外电子总数为8的分子
C.图2为上述六种元素中的一种元素形成的含氧酸的结构
D.e单质能与c的最高价氧化物对应水化物的溶液发生反应
【答案】B
【解析】
图1表示K、Cu、Si、H、C、N六种元素单质的熔点高低,其中c、d均是热和电的良导体,c的熔点低,c为K,d为Cu,e常作为半导体材料,e为Si,f熔点最高,为金刚石,则f为C,氮气和氢气熔点低的是氢气,因此a为H,b为N。
A. d的硫酸盐硫酸铜,其水溶液由于铜离子的水解呈酸性,故A正确;
B. a元素为H,b元素为N,两者不可能形成核外电子总数为8的分子,故B错误;
C. 图2为上述六种元素中的一种元素形成的含氧酸的结构即为硝酸的结构,故C正确;
D. e单质能与c的最高价氧化物对应水化物KOH的溶液发生反应生成硅酸钾和氢气,故D正确;
综上所述,答案为B。

【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是_________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_________。
(3)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_________。