题目内容
【题目】(10分)有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
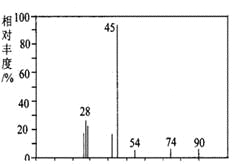
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量是90,则A的分子式是_______________。
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是__________________。
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A 的结构简式是_________________________________。
(4)0.1 mol A与足量Na反应,在标准状况下产生H2的体积是__________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是________________________________________。
【答案】(10分,每空2分)
(1)C3H6O3(2)羧基(3)![]() (4)2.24
(4)2.24
(5)![]()
【解析】
试题(1)根据质荷比分析相对分子质量为90,根据数据分析,A为0.1摩尔,生成水5.4克0.3摩尔,二氧化碳13.2克0.3摩尔,计算A的分子式为C3H6O3。(2)能与碳酸氢钠反应,说明含有羧基。(3)A有四个峰,比值为1:1:1:3,有羧基,所以结构为CH3CH(OH)COOH。(4)羟基和羧基都能与钠反应,故产生0.1摩尔氢气,体积为2.24升。(5)A生成聚酯,是发生的缩聚反应,其反应为:


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。

已知:
温度 | 溶解度/g | ||
K2CO3 | KHCO3 | KMnO4 | |
20℃ | 111 | 33.7 | 6.38 |
请回答:
(1) 反应①的化学方程式为______________________________________,加热软锰矿、KClO3和KOH固体,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有___,不采用瓷坩埚而选用铁坩埚的理由是______________
(2) 反应②中氧化产物与还原产物的物质的量之比为___________________;上述流程中可以循环利用的物质是__________________________。
(3) 实验时,从滤液中得到KMnO4晶体的实验操作a为___________________,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低其原因是________。