题目内容
【题目】一种以海水晒盐后所得苦卤(溶质主要含MgCl2,还有NaCl等)为原料制取金属镁的流程如图:
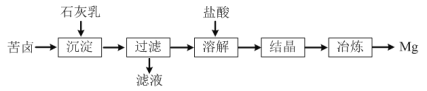
(1)“沉淀”反应的化学方程式为___。
(2)“溶解”反应的离子方程式为___。
(3)工业上冶炼镁时采用的方法是___(填字母)。
a.电解熔融MgCl2
b.用氢气还原MgCl2
c.加热分解MgCl2
【答案】MgCl2+Ca(OH)2=Mg(OH)2+CaCl2 Mg(OH)2+2H+=Mg2++2H2O a
【解析】
苦卤中除MgCl2外还含有NaCl,其与石灰乳混合后,MgCl2会转化为Mg(OH)2沉淀,而NaCl不反应;因此过滤后,需要用其滤渣来制备金属镁;滤渣在用盐酸溶解后,即可得到MgCl2溶液,进一步获得无水氯化镁,再通过电冶金的方式即可获得镁单质。
(1)通过分析可知,“沉淀”步骤发生的是MgCl2与Ca(OH)2的反应,方程式为MgCl2+Ca(OH)2=Mg(OH)2+CaCl2;
(2)通过分析可知,“溶解”步骤是将Mg(OH)2沉淀溶解,离子方程式为Mg(OH)2+2H+=Mg2++2H2O;
(3)Mg单质的活泼性较强,其冶炼方法为电冶金法,即电解熔融的MgCl2,答案选a。

练习册系列答案
相关题目