题目内容
【题目】为除去粗盐中含有的可溶性杂质硫酸盐、氯化钙和氯化镁,某同学利用给定试剂NaOH溶液、BaCl2溶液、Na2CO3溶液和盐酸,设计了如下实验流程:
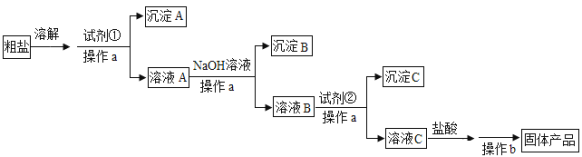
请回答:
(1)操作a和操作b的名称依次是______。
(2)试剂①是______。
(3)加入NaOH后,发生反应的离子方程式是___________。
(4)加入试剂②后,发生反应的离子方程式是___________。
(5)加入盐酸的作用是______。
【答案】过滤、蒸发 BaCl2溶液 Mg2++2OH-=Mg(OH)2↓ Ca2++CO32-=CaCO3↓、Ba2++ CO32-=BaCO3↓ 除去过量的CO32-和OH-
【解析】
由实验流程可知,粗盐溶解后加试剂①为BaCl2,操作a为过滤,得到沉淀A为BaSO4,溶液A含氯化钙、氯化镁、氯化钡,再与NaOH反应时,镁离子转化为沉淀,过滤得到沉淀B为Mg(OH)2,溶液B含氯化钙、氯化钡、NaOH,试剂②为碳酸钠,可除去钙离子、钡离子,过滤分离出沉淀C为BaCO3、CaCO3,溶液C含NaCl、NaOH、碳酸钠,再加盐酸反应后,蒸发结晶得到固体产品。
(1) 根据上述分析知操作a为过滤,操作b为蒸发,故答案为:过滤、蒸发;
(2) 根据上述分析知,粗盐提纯过程中首先除去硫酸根,所以试剂①是BaCl2溶液,故答案为:BaCl2溶液;
(3) 加入NaOH后,主要是将镁离子沉淀,发生反应的离子方程式是Mg2++2OH-=Mg(OH)2↓,故答案为:Mg2++2OH-=Mg(OH)2↓;
(4) 加入试剂②碳酸钠后,主要生成碳酸钙和碳酸钡沉淀,发生反应的离子方程式是Ca2++CO32-=CaCO3↓、Ba2++ CO32-=BaCO3↓,故答案为:Ca2++CO32-=CaCO3↓、Ba2++ CO32-=BaCO3↓;
(5) 加入盐酸的作用是除去过量的CO32-和OH-,故答案为:除去过量的CO32-和OH-。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48,下列说法不正确的是
X | Y | |
Z | W |
A.原子半径(r)大小比较:![]()
B.X和Y可形成共价化合物XY、![]() 等化合物
等化合物
C.Y的非金属性比Z的强,所以Y的最高价氧化物的水化物酸性大于Z
D.Z的最低价单核阴离子的失电子能力比W的强