题目内容
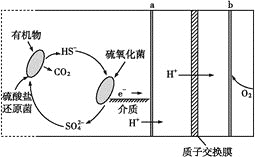
【题目】2017年冬季,我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。城市雾霾中还含有铜等重金属元素。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________,金属铜的晶体中,铜原子的堆积方式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___________。
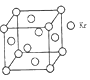
(4)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,晶胞边长为540pm,则该晶体的密度___________g/cm3(只列式不计算)(1pm=10-10cm)
【答案】2 3d104s1 面心立方堆积 O 正四面体 6 ![]()
【解析】
(1)N位于周期表中第2周期第ⅤA族,Cu位于周期表中第4周期第ⅠB族,铜原子的堆积方式为ABCABC……,据此分析判断;
(2)N为半满结构,较为稳定,第一电离能反常大,根据VSEPR理论判断SO42-的空间构型;
(3)NO和H2O为单齿配体,据此分析配位数;
(4)根据均摊法确定一个晶胞中含有的粒子数目,由ρ=![]() 计算晶体密度。
计算晶体密度。
(1)N位于周期表中第2周期第ⅤA族,则N元素核外电子排布式为1s22s22p3,核外电子云形状有2种;Cu位于周期表中第4周期第ⅠB族,则其价电子排布式为3d104s1,
金属铜的晶体中,铜原子的堆积方式为密置层ABCABC……堆积,所以铜原子的堆积方式为面心立方最密堆积,故答案为:2;3d104s1;面心立方最密堆积;
(2)N为半满结构,较为稳定,第一电离能反常大,所以N和O中第一电离能较小的元素是O;对于SO42-,根据VSEPR理论,价电子对数=4+![]() =4,VSEPR模型为四面体,所以其空间构型为正四面体,故答案为:O;正四面体;
=4,VSEPR模型为四面体,所以其空间构型为正四面体,故答案为:O;正四面体;
(3)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,配体为NO和H2O,均为单齿配体,所以配位数为6,故答案为:6;
(4)顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,则1个晶胞中含有粒子数目为8×
,则1个晶胞中含有粒子数目为8×![]() +6×
+6×![]() =4个,不妨取1mol这样的晶胞,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3×6.02×1023cm3,则晶体密度为ρ=
=4个,不妨取1mol这样的晶胞,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3×6.02×1023cm3,则晶体密度为ρ=![]() =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() (或
(或![]() )。
)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48,下列说法不正确的是
X | Y | |
Z | W |
A.原子半径(r)大小比较:![]()
B.X和Y可形成共价化合物XY、![]() 等化合物
等化合物
C.Y的非金属性比Z的强,所以Y的最高价氧化物的水化物酸性大于Z
D.Z的最低价单核阴离子的失电子能力比W的强