题目内容
常温下,将0.01 mol·L-1 Na2SO3溶液与0.01 mol·L-1 KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量( )
| A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-) |
| B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-) |
| C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L |
| D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+) |
B
试题分析:A.根据电荷守恒可得C(K+)+C(Na+)+C(H+)=2C(SO32-)+C(HSO3-)+C(OH-).错误。B.根据电荷守恒可得C(K+)+C(Na+)+C(H+)=2C(SO32-)+C(HSO3-)+C(OH-);根据微粒的物质的量的关系可得C(Na+) =C(SO32-)+C(HSO3-) +C(H2SO3)。代入第一个式子,整理可得C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-)。正确。C.混合后溶液中的微粒根据物料守恒关系可知: C(SO32-)+C(HSO3-)+C(H2SO3)=(0.01+0.01)÷2="0.01" mol/L.错误。D.两溶液混合前,在Na2SO3溶液中,由于SO32-是H2SO3二级电离产生的离子,而KHSO3溶液中HSO3-是H2SO3一级电离产生的离子,所以SO32-一级水解水解程度大于二级HSO3-的水解程度。水解程度越大,水电离产生的离子浓度越大。因此两溶液混合前,Na2SO3溶液中,水电离出C(H+)大于KHSO3溶液中水电离出C(H+)。错误。

练习册系列答案
相关题目
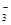 >HSO3-
>HSO3-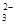 >SO
>SO )+c(H2CO3)
)+c(H2CO3)
 。
。 )
)
 ___pH
___pH 。(填
。(填
 NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体