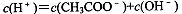题目内容
下列有关叙述正确的是 ( )
A.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO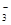 )+c(H2CO3) )+c(H2CO3) |
| B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍 |
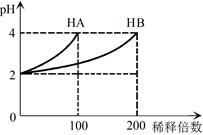
| C.100 ml pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强 |
| D.pH=5.5的CH3COOH与CH3COONa混合溶液中:c(Na+)> c(CH3COO-) |
B
试题分析:A、根据元素守恒规律,应有c(HClO)+c(ClO-)= c(HCO
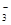 )+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶液的体积相等,氢离子浓度相等,与足量锌反应产生的氢气HA多,说明酸HA的浓度比酸HB的浓度大,酸性弱,错误;D、CH3COOH与CH3COONa混合溶液的pH=5.5,说明醋酸电离程度大于醋酸根离子水解程度,所以c(Na+)<c(CH3COO-),错误,答案选B。
)+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶液的体积相等,氢离子浓度相等,与足量锌反应产生的氢气HA多,说明酸HA的浓度比酸HB的浓度大,酸性弱,错误;D、CH3COOH与CH3COONa混合溶液的pH=5.5,说明醋酸电离程度大于醋酸根离子水解程度,所以c(Na+)<c(CH3COO-),错误,答案选B。
练习册系列答案
相关题目