题目内容
(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H= kJ?mol-1。
(2)利用氧化氮氧化物的流程如下:
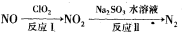
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移0.5mol电子,则反应Ⅱ中可生成N2的体积
为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________移动(填“向左”、“向右”或“不”);试计算溶液中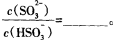 。
。
(常温下H2SO3的电离常数: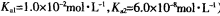 )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。
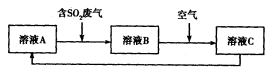
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②假设反应过程中溶液的体积不变,A、C两溶液的pH大小关系为:pH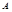 ___pH
___pH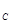 。(填
。(填
“>”、“=”或“<”)。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_____________________________________________________________________________。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H= kJ?mol-1。
(2)利用氧化氮氧化物的流程如下:
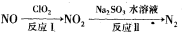
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移0.5mol电子,则反应Ⅱ中可生成N2的体积
为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________移动(填“向左”、“向右”或“不”);试计算溶液中
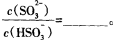 。
。(常温下H2SO3的电离常数:
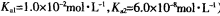 )
)(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。

①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②假设反应过程中溶液的体积不变,A、C两溶液的pH大小关系为:pH
 ___pH
___pH 。(填
。(填“>”、“=”或“<”)。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_____________________________________________________________________________。
(l)—11601。(2)2NO2+4Na2SO3 N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
 N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。试题分析:(l)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1,根据盖斯定律:②×2—①,
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=—1160kJ?mol-1。(2)根据题给流程图知,反应Ⅱ为二氧化氮与亚硫酸钠溶液反应生成氮气和硫酸钠,化学方程式为2NO2+4Na2SO3
 N2+4Na2SO4;由反应I知,生成1molNO2转移5mol电子,若反应I中转移0.5mol电子,则反应Ⅰ 中生成0.1molNO2,由反应Ⅱ可知,生成N2的物质的量为0.05mol,标准状况下体积为1.12L。(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中溶液由强碱溶液转化为水解呈碱性的盐溶液,水的电离平衡向右移动;由H2SO3的二级电离常数表达式表达式知,
N2+4Na2SO4;由反应I知,生成1molNO2转移5mol电子,若反应I中转移0.5mol电子,则反应Ⅰ 中生成0.1molNO2,由反应Ⅱ可知,生成N2的物质的量为0.05mol,标准状况下体积为1.12L。(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中溶液由强碱溶液转化为水解呈碱性的盐溶液,水的电离平衡向右移动;由H2SO3的二级电离常数表达式表达式知, 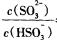 =Ka2/c(H+)=6.0×10—8/10—9=60。(4)①用Fe2(SO4)3晶体配制Fe2(SO4)3溶液时要注意防止铁离子水解,方法是先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②由题给流程知,该过程中发生的总反应为:2SO2+O2+2H2O==2H2SO4,A、C两溶液的pH大小关系为:pHA<pHC。③验证溶液B是否仍具有处理废气的能力,即为检验溶液B中是否含有铁离子,实验的操作、现象和结论是取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
=Ka2/c(H+)=6.0×10—8/10—9=60。(4)①用Fe2(SO4)3晶体配制Fe2(SO4)3溶液时要注意防止铁离子水解,方法是先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②由题给流程知,该过程中发生的总反应为:2SO2+O2+2H2O==2H2SO4,A、C两溶液的pH大小关系为:pHA<pHC。③验证溶液B是否仍具有处理废气的能力,即为检验溶液B中是否含有铁离子,实验的操作、现象和结论是取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
练习册系列答案
相关题目
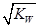 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1 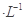 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是