题目内容
下列有关电解质溶液的说法正确的是
| A.在溶质物质的量浓度相等的Na2A和NaHA溶液中,阴离子总数相等 |
| B.中和等体积pH=11的氢氧化钠溶液,所需pH=3醋酸溶液的体积大于pH=3盐酸的体积 |
| C.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液,浓度关系: c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl) |
| D.酸式盐NaHA的水溶液呈碱性,离子的物质的量浓度关系:c(Na+)>c(HA—)>c(OH—)>c(H+)>c(A2—) |
D
试题分析:A、如果H2A为弱酸,则A2-水解生成HA-和OH?,阴离子总数增大,错误;B、pH=3醋酸溶液的浓度远远大于pH=3盐酸,所以中和等体积pH=11的氢氧化钠溶液,所需pH=3醋酸溶液的体积小于pH=3盐酸的体积,错误;C、根据化学式,c(NH4+)相等的NH4Cl溶液浓度最大,(NH4)2CO3溶液中NH4+和CO32?的水解相互促进,NH4+水解程度增大,所以浓度关系:c[(NH4)2SO4] < c[(NH4)2CO3]<c(NH4Cl),错误;D、酸式盐NaHA的水溶液呈碱性,说明HA-的水解程度大于电离程度,所以离子的物质的量浓度关系:c(Na+)>c(HA—)>c(OH—)>c(H+)>c(A2—),正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
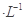 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是