题目内容
17.对11→17号元素性质的描述正确的是( )| A. | 原子半径和简单离子半径减小 | |
| B. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| C. | 14号元素的高纯单质可制光电池 | |
| D. | 单质的熔点降低 |
分析 A、随着原子序数的递增,原子半径逐渐减小,而离子半径阴离子大于阳离子,且阴离子、阳离子中原子序数大的离子半径小;
B、必须是最高价氧化物对应的水化物,不是最高价,不一定满足;
C、14号元素是硅,是半导体材料;
D、金属单质的熔点降低,而非金属单质中,原子晶体沸点大于金属晶体,分子晶体沸点较低.
解答 解:A、随着原子序数的递增,原子半径逐渐减小,而离子半径阴离子大于阳离子,且阴离子、阳离子中原子序数大的离子半径小,故A错误;
B、必须指出是最高价氧化物对应的水化物的碱性减弱,酸性增强,否则不一定成立,故B错误;
C、14号元素是硅,是半导体材料,所以高纯单质硅可制光电池,故C正确;
D、金属单质的熔点降低,Si单质为原子晶体,则单质熔点大小为:Na<Mg<Al<Si(原子晶体),其它非金属单质P、S、Cl2为分子晶体,熔点比金属单质低,故整体趋势为:Si>Al>Mg>S>P>Na>Cl2,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确元素周期律的内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,B为易错点,注意必须是最高价氧化物对应的水化物.

练习册系列答案
相关题目
8.金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可采用电解其熔融物法回收锂而循环使用.其工作示意图如右图,下列说法不正确的是( )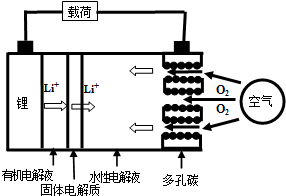

| A. | 放电时负极的电极反应式为:Li-e-=Li+ | |
| B. | 熔融的氢氧化锂用惰性电极电解再生时,金属锂在阴极得到 | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 放电时,正极的电极反应式为:2H2O+O2+4e-=4OH- |
5.m mol乙炔跟n mol氢气在密闭容器中反应,当其达到平衡时生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
| A. | (3m+n)mol | B. | (3m+n+2p)mol | C. | (2.5m+0.5n-3p)mol | D. | (2.5m+0.5n)mol |
12.设阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA | |
| B. | 0.1molCmH2n+2中含有的碳碳单键数为0.1nNA | |
| C. | 2.8g乙烯和丙烯的混合气体中所含碳原子为0.2NA | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4NA |
2.下列离子方程式中书写正确的是( )
| A. | 铝粉与烧碱溶液反应:Al+6OH+═[Al(OH)4]-+H2↑ | |
| B. | 水玻璃中加入稀盐酸:Na2SiO4+2H+═H2SiO3↓+2Na+ | |
| C. | 二氧化硅与苛性钠溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 将氯气通入到水中:Cl2+H2O═2HCl-+ClO- |
9.下列有机反应的方程式书写错误的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. |  +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$ +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$ |
7.下列有关图象说法正确的是( )
| A. | 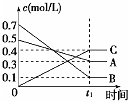 表示反应的方程式为5A(g)+7B(g)?4C(g) | |
| B. | 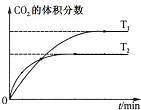 表示反应5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0 | |
| C. | 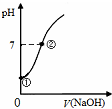 表示向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液的pH 变化,①到②水的电离程度逐渐减小 | |
| D. | 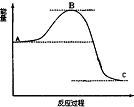 表示4H2(g)+2NO2(g)=N2(g)+4H2O(g)反应过程的能量变化,加入催化剂,将使C 点降低 |
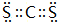 ,Y3-的立体构型为直线形.
,Y3-的立体构型为直线形.