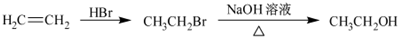题目内容
2.现有X、Y、Z、W、Q五种前30号元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,X的最外层有两个未成对电子,元素W与元素Z同主族,Q的基态原子中有5个未成对电子且Q的次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:(1)上述五种元素中电负性最大的是O(填元素符号),Y的第一电离能大于Z的第一电离能原因N原子3p轨道半充满,相对稳定.
(2)XW2的电子式为
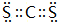 ,Y3-的立体构型为直线形.
,Y3-的立体构型为直线形.(3)Q的价电子排布式为3d54s2,位于周期表d区.
(4)W与Z组成的最高价分子中W的杂化类型是sp2.
(5)已知α型QW的晶胞中阴阳离子的配位数均为6,则与Q离子距离最近且距离相等的Q离子个数是12.
(6)α型QW的晶胞是立方体,其摩尔质量是Mg/mol,该晶体晶胞边长为a cm,该晶体的密度为ρg/cm3,请列式表示出一个晶胞中含有的离子总数为2$\frac{ρ{a}^{3}{N}_{A}}{M}$(阿伏加德罗常数用NA表示).
分析 X、Y、Z、W、Q五种前30号元素,原子序数依次增大,X、Y、Z、W均为非金属元素,元素W与元素Z同主族,则W位于第三周期、Z位于第二周期,W能形成二价阴离子,则W是S元素、Z是O元素;
X的最外层有两个未成对电子,且原子序数小于Z,则X是C元素、Y是O元素;
Q的基态原子中有5个未成对电子且Q的次外层电子数等于Y和W2-最外层电子数之和,则Q是Mn元素,
(1)元素的非金属性越强,其电负性越大;Y是N元素、Z是氧元素,原子轨道中电子处于半满、全满或全空时最稳定;
(2)CS2为直线型分子,每个S原子和C原子形成两个共用电子对;
根据价层电子对互斥理论判断Y3-的立体构型;
(3)Q是Mn元素,其3d、4s能级上电子为其价电子;该元素位于d区;
(4)S与O组成最高价分子是SO3,该分子中S原子价层电子对个数是3且不含孤电子对;
(5)α型MnS的晶胞中阴阳离子的配位数均为6,其晶胞结构和氯化钠相似,则与Q离子距离最近且距离相等的Q离子个数=3×8×$\frac{1}{2}$;
(6)α型MnS的晶胞是立方体,该物质一个晶胞中阴离子总数=$\frac{ρV{N}_{A}}{M}$,阴阳离子个数相等,离子总数是阴离子的2倍.
解答 解:X、Y、Z、W、Q五种前30号元素,原子序数依次增大,X、Y、Z、W均为非金属元素,元素W与元素Z同主族,则W位于第三周期、Z位于第二周期,W能形成二价阴离子,则W是S元素、Z是O元素;
X的最外层有两个未成对电子,且原子序数小于Z,则X是C元素、Y是O元素;
Q的基态原子中有5个未成对电子且Q的次外层电子数等于Y和W2-最外层电子数之和,则Q是Mn元素,
(1)元素的非金属性越强,其电负性越大,这几种元素非金属性最强的是O元素,则电负性最大的是O元素;Y是N元素、Z是氧元素,原子轨道中电子处于半满、全满或全空时最稳定,N原子电子处于半满状态,所以N元素第一电离能大于O元素,
故答案为:O;N原子3p轨道半充满,相对稳定;
(2)CS2为直线型分子,每个S原子和C原子形成两个共用电子对,电子式为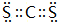 ;
;
N3-中中心N原子价层电子对个数是2,且不含孤电子对,所以为直线形结构,
故答案为: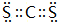 ;直线形;
;直线形;
(3)Q是Mn元素,其3d、4s能级上电子为其价电子,价电子排布式为3d54s2;该元素位于d区,
故答案为:3d54s2;d;
(4)S与O组成最高价分子是SO3,该分子中S原子价层电子对个数是3且不含孤电子对,为sp2杂化,
故答案为:sp2;
(5)α型MnS的晶胞中阴阳离子的配位数均为6,其晶胞结构和氯化钠相似,则与Q离子距离最近且距离相等的Q离子个数=3×8×$\frac{1}{2}$=12,故答案为:12;
(6)α型MnS的晶胞是立方体,该物质一个晶胞中阴离子总数=$\frac{ρV{N}_{A}}{M}$=$\frac{ρ{a}^{3}{N}_{A}}{M}$,阴阳离子个数相等,离子总数是阴离子的2倍,所以离子总数为2$\frac{ρ{a}^{3}{N}_{A}}{M}$,
故答案为:2$\frac{ρ{a}^{3}{N}_{A}}{M}$.
点评 本题考查物质结构和性质,为高频考点,把握均摊法、价层电子对互斥理论、原子核外电子排布等知识点即可解答,难点是(6)题晶胞计算,知道该晶胞中阴阳离子个数体系,题目难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案①纳米材料微粒直径一般从几纳米到几十纳米(1nm=10-9 m),因此纳米材料属于胶体
②往Fe(OH)3胶体中逐滴加入过量的硫酸会先产生沉淀而后沉淀逐渐溶解
③氢氧化铁胶体稳定存在的主要原因是胶粒带电荷
④依据丁达尔现象可将分散系分为溶液、胶体与浊液
⑤AgI胶体在电场中自由运动.
| A. | ③④⑤ | B. | ①②④ | C. | ②③ | D. | ①⑤ |
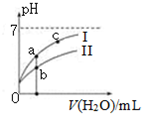 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②H2O(l)=H2O(g)△H=+44.0kJ•mol-1
写出表示甲醇燃烧热的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.
(2)甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H=-72.0kJ/mol
①该反应的平衡常数表达式为K=$\frac{c(C{O}_{2}){c}^{3}({H}_{2})}{c(C{H}_{3}OH)c({H}_{2}O)}$.
②下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小的是(双选)CD.
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.恒容再充入1molH2O(g)
(3)甲醇可以氧化成甲酸,在常温下用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)<
(填“<”或“>”或“=”) 20.00mL.
(4)利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(5)合成甲醇的主要反应为:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol原料气的加工过程中常常混有一些CO2,为了研究温度及CO2含量对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验.实验数据见下表:
| CO2%-CO%-H2% (体积分数) | 0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | ||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| 生成CH3OH的碳转化率(%) | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 |
结论一:在一定条件下,反应温度越高,生成CH3OH的碳转化率越高.
结论二:原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲醇的碳转化率又降低.
 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 图中的b>a | |
| D. | 该过程中的产品还有H2SO4 |
| A. | 能使甲基橙显红色的溶液中大量存在:Mg2+、Na+、Cl-、F- | |
| B. | 标准状况下,46gNO2和N2O4混合气体中含有原子个数为3NA | |
| C. | 1L0.5mol•L-1 CuSO4溶液中含有0.5NA个Cu2+ | |
| D. | 浓度均为0.1 mol/L的氨水和盐酸、由水电离出的c(H+):盐酸>氨水 |
| A. | C3H7Cl | B. | C3H6Cl2 | C. | C3H5Cl3 | D. | C3HCl7 |
| A. | 原子半径和简单离子半径减小 | |
| B. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| C. | 14号元素的高纯单质可制光电池 | |
| D. | 单质的熔点降低 |

 ;
;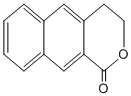 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息,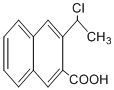 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: