题目内容
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
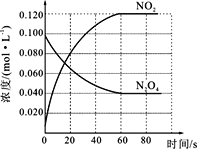
(1)反应的ΔH_______0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为_____________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4) 以0.001 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是________________。 ②温度T时反应的平衡常数K2____________________。
(3)温度T时反应达平衡后,将反应容器的容积扩大一倍。平衡向____________ (填“正反应”或“逆反应”)方向移动,判断理由是_______________________________________________________。
【答案】大于 0.001 0.36 大于 反应正向移动,正反应方向吸热 0.65 正反应 减小压强反应向气体分子数增多的方向移动
【解析】
(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L-0.04mol/L=0.06mol/L,v(N2O4)=![]() =0.001 mol·L-1·s-1;反应的平衡常数K1为
=0.001 mol·L-1·s-1;反应的平衡常数K1为![]() =0.36mol/L,故答案为:大于、0.001molL-1s-1、0.36;
=0.36mol/L,故答案为:大于、0.001molL-1s-1、0.36;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于、正反应方向吸热,反应向吸热方向移动,故温度升高;
②平衡时,c(NO2)=0.120molL-1+0.001molL-1s-1×10s×2=0.14molL-1,c(N2O4)=0.04molL-1-0.001molL-1s-1×10s=0.030molL-1,K2=![]() =0.65 molL-1,故答案为:0.65;
=0.65 molL-1,故答案为:0.65;
(3)反应容器的容积扩大一倍,压强减小,正反应方向气体体积增大,减小压强向着气体体积增大的方向移动,故答案为:正反应、对气体体积增大的反应,减小压强平衡向在反应方向移动。

【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质的溶液,pH由大到小的顺序是___________(填编号)。
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离常数___________(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中水电离出来的c(H+)_________(填“大于”、“等于”或“小于”)醋酸溶液水电离出来的c(H+)。

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______________________(填准确数值)。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时c mol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=_____________________。(用含“ c、a的代数式表示”)
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ (mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正.逆反应速率的大小:v正_______v逆(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=___________;该时间内反应速率v(CH3OH)=___________。
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
