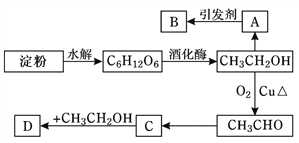
题目内容
【题目】实验室制备乙酸乙酯的装置,如图所示,回答下列问题:

(1)乙醇、乙酸和浓硫酸混合顺序应为_____________________。
(2)收集乙酸乙酯的试管内盛有的饱和碳酸钠溶液的作用是____________________。
(3)反应中浓硫酸的作用________________________________。
(4)反应中乙醇和乙酸的转化率不能达到100%,原因是_______________________。
(5)收集在试管内的乙酸乙酯是在碳酸钠溶液的________层。
(6)该反应的化学方程式为______________________。
(7)将收集到的乙酸乙酯分离出来的方法为__________。
【答案】向乙醇中慢慢加入浓硫酸和乙酸 中和乙酸,溶解乙醇,降低乙酸乙酯在水层中的溶解度,便于分层析出 催化剂和吸水剂 乙醇与乙酸的酯化反应为可逆反应,不能进行到底 上 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 分液
CH3COOCH2CH3+H2O 分液
【解析】
(1)浓硫酸密度比水大,溶解时放出大量的热,为防止酸液飞溅,加入药品时应先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最后再加入乙酸;答案:先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最后再加入乙酸;
(2)乙酸乙酯不溶于饱和碳酸钠溶液,乙醇易溶于水,乙酸可与碳酸钠发生反应而被吸收,用饱和碳酸钠溶液可将乙酸乙酯和乙醇、乙酸分离,所以饱和碳酸钠的作用为中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度;
答案:中和乙酸,溶解乙醇,降低乙酸乙酯在水层中的溶解度,便于分层析出;
(3)由于是可逆反应,因此反应中浓硫酸的作用是催化剂和吸水剂;
答案:催化剂和吸水剂
(4)因为乙酸与乙醇发生的酯化反应为可逆反应,反应不能进行到底,所以反应中乙醇和乙酸的转化率不能达到100%;
答案:乙醇与乙酸的酯化反应为可逆反应,不能进行到底
(5)因为乙酸乙酯密度比水小,难溶于水,所以收集在试管内的乙酸乙酯是在碳酸钠溶液的上层;
答案:上
(6)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
答案:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
(7)互不相溶的液体可用分液的方法分离,由于乙酸乙酯不溶于水,所以将收集到的乙酸乙酯分离出来的方法为分液;
答案:分液。

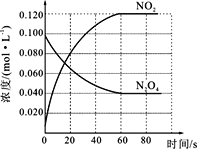
【题目】已知:N2O4(g)![]() 2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4,发生反应获得如下数据:
2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4,发生反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol/L | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是
A. 升高温度会使混合气体的颜色变浅
B. 反应达平衡时,吸收的热量为0.30Q kJ
C. 20~40s内,v(N2O4)=0.004mol/(L·s)
D. 100s时再充入0.40mo1N2O4,达到新平衡时N2O4的转化率增大